- Помогите пожалуйста решить
- Раствор приобретает малиновую окраску
- Индикатор фенолфталеин
- Название, физические свойства и формула индикатора
- Как получают фенолфталеин
- Окраска фенолфталеина в растворах
- Рабочее значение перехода окраски
- Другие кислотно-основные индикаторы
- Приготовление раствора фенолфталеина
- Области применения индикатора
- Почему фенолфталеин меняет цвет
- Хранение, меры предосторожности
Помогите пожалуйста решить
В пробирку с 1 мл. раствора гидроксида натрия добавьте 1-2 капли фенолфталеина. Раствор приобретает малиновый цвет. Затем прилейте соляной кислоты до обесцвечивания. В другую пробирку с сульфатом меди (II) добавьте раствор гидроксида натрия до образования голубого осадка. Налейте в этот осадок соляную кислоту до растворения осадка. Составьте уравнение реакций в молекулярном и ионном виде.
В пробирку с 1 мл раствора гидроксида натрия при добавлении 1-2 капель фенолфталеина раствор приобретает малиновый цвет, поскольку фенолфталеин является индикатором, который меняет цвет в присутствии щелочного раствора. Уравнение для этой реакции может быть записано в молекулярной форме в виде:
Фенолфталеин + гидроксид натрия -> Малиновый цвет
В ионной форме уравнение для этой реакции может быть записано в виде:
C20H14O4 + NaOH -> Малиновый цвет
Когда соляную кислоту добавляют в раствор до изменения цвета, реакцию можно представить в молекулярной форме в виде:
Гидроксид натрия + соляная кислота -> Хлорид натрия + Вода
В ионной форме уравнение для этой реакции может быть записано в виде:
NaOH + HCl -> NaCl + H2O
Во второй пробирке с сульфатом меди (II) добавление раствора гидроксида натрия до образования синего осадка может быть представлено в молекулярной форме в виде:
Сульфат меди (II) + гидроксид натрия -> Гидроксид меди (II) + сульфат натрия
В ионной форме уравнение для этой реакции может быть записано в виде:
CuSO4 + NaOH -> Cu(OH)2 + Na2SO4
Когда к осадку добавляют соляную кислоту до тех пор, пока осадок не растворится, реакцию можно представить в молекулярной форме в виде:
Гидроксид меди (II) + соляная кислота -> Хлорид меди (II) + Вода
В ионной форме уравнение для этой реакции может быть записано в виде:
Cu(OH)2 + HCl -> CuCl2 + H2O
Источник
Раствор приобретает малиновую окраску
Разместили на страницах «Варианты» прошлогодние варианты с решениями по всем предметам, кроме математики
Разместили прошлогодние варианты с решениями экзамена 2020 года по русскому языку, немецкому языку, физике, биологии, химии и географии
04.05.2017
Открываем математику в режиме тестирования
02.05.2017
Открываем физику в режиме тестирования
29.04.2017
Открываем биологию в режиме тестирования
24.05.2017
Открываем мировую историю в режиме тестирования
19.04.2017
Открываем немецкий язык в режиме тестирования
16.04.2017
Открываем английский язык в режиме тестирования
10.04.2017
Открываем испанский язык в режиме тестирования
05.04.2017
Открываем русский язык в режиме тестирования
01.02.2017
Здесь будет город-сад!
Тип A9 № 509
Фенолфталеин приобретает малиновую окраску в растворе, который образуется при растворении в воде оксида:
Фенолфталеин приобретает малиновую окраску в щелочной среде.
Оксид при растворении в воде образует серную кислоту, которая имеет кислую среду.
Оксид при растворении в воде образует гидроксид кальция, который имеет щелочную среду.
Оксиды и не растворяются и не взаимодействуют с водой, поскольку оксид является несолеобразующим, а оксид является амфотерным.
Правильный ответ указан под номером 2.
Источник
Индикатор фенолфталеин
Фенолфталеин – это индикатор из группы кислотно-основных. Данное вещество помогает определять водородный показатель жидкостей, то есть кислотность исследуемых растворов. При изменении pH среды фенолфталеин изменяет свой оттенок, что позволяет определять принадлежность образца к кислотам или щелочам. В данной статье рассмотрим свойства соединения и сферу его применения.
Название, физические свойства и формула индикатора
Впервые в 71 году XIX столетия индикаторное вещество было в ходе лабораторной реакции выделено химиком из Германии Адольфом фон Байером. Оно получило название «фенолфталеин», но в химии применяются и иные обозначения: 3,3-бис-(4-гидроксифенил)фталид, 4,4′-диоксифталофенон, 3,3-бис(4-гидроксифенил)-1(3Н)-изобензофуранон. Общепринятая формула сложного соединения выглядит так: C20H14O4. В обычных условиях фенолфталеин имеет вид порошка из мелких кристаллов – ромбов микроскопических размеров. Цвет или отсутствует, или слегка желтоватый. Вкуса нет, запах специфический. В воде индикатор практически не растворяется, зато демонстрирует хорошую растворимость в этаноле (спирте), в диэтиловом эфире.
| Это интересно! Известный слабительный препарат «Пурген» – это и есть фенолфталеин. Средство от запоров на основе данного вещества использовали долгое время до момента выявления его опасных побочных эффектов. |
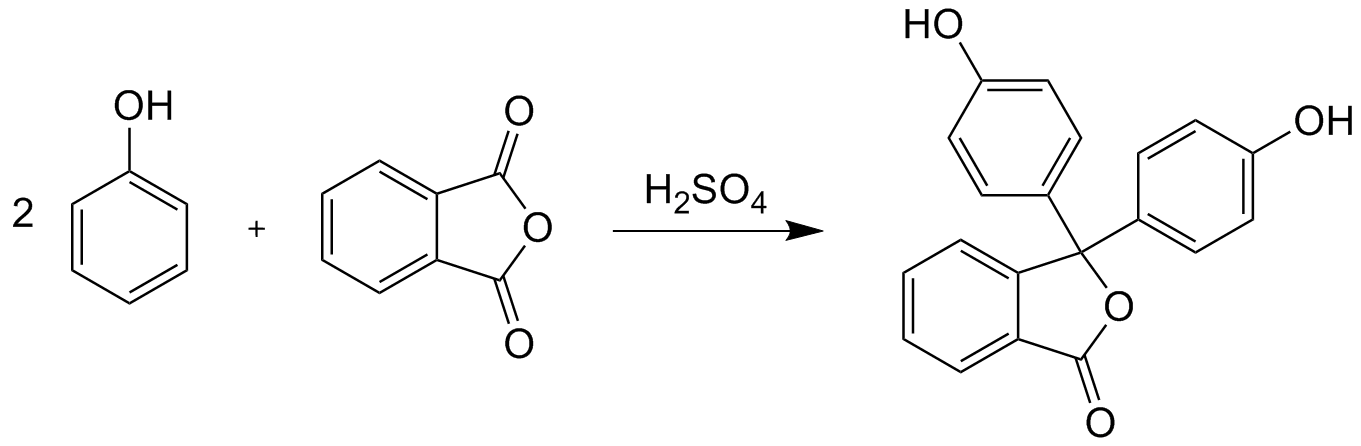
Как получают фенолфталеин
В лабораторных и промышленных условиях вещество можно получить в ходе конденсации фенола с фталевым ангидридом в присутствие серной кислоты. Вся смесь подвергается нагреву до момента образования осадка в виде кристаллов. Далее следует отделить раствор от осадка путем сливания жидкости, чтобы довести конечный продукт до порошкообразного состояния. Полученный порошок можно использовать для приготовления рабочих растворов.
Окраска фенолфталеина в растворах
При разных значениях pH фенолфталеин приобретает окраску в растворе от оранжевого до розового разной интенсивности. Оттенок зависит от водородного показателя исследуемого образца. Фенолфталеин в кислоте сильной становится оранжевым. Если среда нейтральная либо слабокислая, то вещество остаётся бесцветным, не меняет оттенок изучаемой жидкости. Малиновая окраска фенолфталеина – в растворе щелочном. Но если среда сильнощелочная, то вещество будет оставаться бесцветным.
Рабочее значение перехода окраски
- От 0 до 3 – сильнокислые среды. Оттенок становится оранжевым.
- От 4 до 8 – слабокислые растворы и нейтральные. В них вещество остаётся прозрачным.
- От 8,2 до 10 единиц – слабощелочные и щелочные растворы. В них возникает малиновая окраска – от сиреневого и светло-розового до фуксинового, пурпурного, ярко-фиолетового оттенка. Интенсивность зависит от pH.
- Более 11-12 единиц – сильнощелочные среды. В них индикатор сохраняет прозрачность.
Шкала pH включает значения от 0 единиц до 14. Но при титровании нужно уточнить показатель кислотности, совпадающий с конечной точкой анализа. Она определяется по центральному участку зоны перехода кислотно-основного индикаторного соединения из одного оттенка в другой.
Фенолфталеин демонстрирует наибольшую информативность в щелочных растворах. Интервал его перехода относится к диапазону 8,2-10 pH. То есть рабочее значение равно 9 единицам.
Другие кислотно-основные индикаторы
Фенолфталеин входит в категорию кислотно-основных индикаторов. Это соединения органической природы, которые изменяют свой оттенок при разных значениях pH. Такие вещества имеют невысокую себестоимость и несложное применение, поэтому широко используются в химии.
Помимо рассматриваемого фенолфталеина, к группе кислотно-основных индикаторных веществ относятся также метиловый оранжевый, бромтимоловый синий, лакмус, тимолфталеин, метиловый красный, лакмоид, конго красный, индигокармин, малахитовый зелёный, тропеолин 00, метиловый фиолетовый и прочие соединения. Все они реагируют на изменения кислотности исследуемых сред, но меняют окраску по-разному.
Приготовление раствора фенолфталеина
Для исследовательских целей используют спиртовой рабочий раствор индикатора фенолфталеина. Чтобы получить его, нужно подготовить само исходное порошковое вещество, чистый спирт (можно медицинский) и дистиллированную воду.
- Спирт требуется развести дистиллированной водой, чтобы получить раствор с массовой долей этанола от 50% до 60%. Для этого в литр спирта вливается около 590 миллилитров воды.
- Надо отмерить около 0,5 грамма индикаторного вещества.
- Остаётся всыпать дозу порошка фенолфталеина в 100 мл спиртового раствора, тщательно размешать.
- Получится бесцветная жидкость, которая будет менять оттенок при разных уровнях pH.
Приобрести чистый индикатор возможно только в специализированных магазинах. Готовить рабочий раствор самостоятельно следует с особой осторожностью.
Есть и другой способ приготовить раствор фенолфталеина – из слабительного препарата «Пургена». Нужно также взять 100 мл спиртового 60%-ного раствора или водки и добавить в него растолчённые таблетки в количестве, соответствующем 0,5 г действующего компонента. Далее жидкость фильтруется. Но в РФ найти «Пурген» в аптечных сетях невозможно.
Области применения индикатора
Индикатор фенолфталеин очень востребован. Сфера его применения охватывает несколько областей:
- Химия: аналитическая, биохимия. Вещество используют при титровании для определения концентраций компонентов смесей, при оценке кислотности или щёлочности изучаемой среды, при качественных исследованиях для выявления в образцах некоторых химических элементов типа цинка, магния, кадмия, свинца. Также фенолфталеин входит в состав отдельных комплексных индикаторов (в том числе тестовых полосок), применяемых для выявления точного уровня кислотности буферных или иных растворов.
Полезная информация! Для изучения pH индикатор добавляется в раствор в объёме 2-3 капель. Результаты можно оценивать уже спустя три секунды.
Почему фенолфталеин меняет цвет
Почему фенолфталеин приобретает характерный оттенок при изменении водородного показателя? Эта способность обусловлена ионизацией. Данный процесс происходит при приобретении или утере молекулой электронов. Частица получает определённый электрический заряд – положительный или отрицательный. Ионизированные молекулы взаимодействуют с прочими молекулами: притягивают их при противоположном заряде либо отталкивают, если заряд идентичный. Кроме того, pH влияет и на форму частиц.
Электрический заряд и конфигурация молекулы определяют реакцию на проходящий через структуру поток света. В нормальных условиях фенолфталеин полностью прозрачный, потому что пропускает весь световой спектр – все семь цветов. Но фенолфталеин в щелочной среде блокирует синий оттенок, который при прохождении через кристаллы трансформируется в розоватый. И чем водородный показатель выше, чем сильнее щёлочь, тем интенсивнее розовый окрас индикатора.
Хранение, меры предосторожности
Вещество относится ко второму классу опасности, поэтому при работе с ним следует соблюдать определённые меры предосторожности:
- Транспортировка и хранение допустимы в металлической таре – герметично закрытых ёмкостях из нержавеющей стали.
- Готовить растворы или использовать их для исследований можно только в средствах индивидуальной защиты – плотных эластичных перчатках, очках, респираторе и костюме с длинными рукавами. При случайном попадании на слизистые оболочки или кожу вероятны сильные химические ожоги.
- При контакте с фенолфталеином нужно тщательно промыть поражённые участки тела проточной водой, а потом обратиться за медицинской помощью.
- При хранении нельзя допускать нагрева или воздействия отрицательных температур. Помещение должно быть защищённым от ультрафиолета, влаги и детей.
- Для проведения анализов можно использовать только специализированную посуду – выполненную из химико-лабораторного стекла.
- Отработанный раствор и контактировавшее с ним лабораторное оборудование нельзя выбрасывать в бытовые урны. Недопустим слив в канализацию, почву и водоёмы. Вещество и посуда утилизируются по правилам обращения с опасными химикатами – помещается в герметичные пакеты и отправляется в пункты переработки.
Срок годности сухого порошкового индикатора в закрытой таре – год. Готовый раствор хранится всего месяц.
Фенолфталеин – индикатор со специфическим действием. Он остаётся прозрачным в нейтральных, слабокислых и сильнощелочных средах, но меняет цвет в слабощелочных, сильнокислых и щелочных растворах. Вещество активно используется в разных сферах, является опасным и требует соблюдения мер предосторожности.
Источник