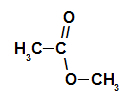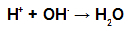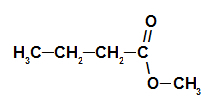- Acetyl
- 6.6.2. Малоновый эфир и синтезы на его основе
- 2 H5c2ooc-ch2-cooc2h5
- Что такое эфир?
- Знайте, какой психологический блок мешает вам осуществить свою мечту
- Клиент, попавший в аферу с WhatsApp, получит от Nubank почти 1500 реалов.
- Приложения для совместного воспитания помогают с опекой над детьми после развода
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Источник 6.6.2. Малоновый эфир и синтезы на его основеМалоновый эфир — это тривиальное название диэтилового эфира малоновой кислоты. Присутствие двух электроноакцепторных этоксикарбонильных групп в малоновом эфире увеличивает подвижность атомов водорода метиленовой группы, так же как и в малоновой кислоте, и в рассмотренном ранее ацетилацетоне (гл. 6.3.2). Малоновый эфир и малоновая кислота относятся к-дикарбонильным соединениям. Но в отличие от молекулы малоновой кислоты в эфире отсутствуют легко диссоциирующие карбоксильные группы, поэтому при действии натрия или алкоголята натрия происходит замещение-водородных атомов металлом — образуется натриймалоновый эфир: Основной причиной проявления СН-кислотности малонового эфира является то, что образующийся анион стабилизирован делокализацией отрицательного заряда с участием двух-связейC=O-групп, и это создаёт условия для его высокой устойчивости. Именно поэтому малоновый эфир является более сильной кислотой, чем этанол. Малоновый эфир проявляет более высокуюСН-кислотность, чем альдегиды и кетоны и большинство эфиров монокарбоновых кислот. Металлическим натрием могут быть замещены как один, так и оба атома водорода метиленовой группы малонового эфира. Анион натриймалонового эфира обладает относительно высокой нуклеофильностью и вступает в реакции нуклеофильного замещения у насыщенного атома углерода. Это свойство используется для получения разнообразных алкил- и диалкилзамещённых малоновых эфиров: , что лежит в основе синтеза Конрада*, широко применяемого для превращения малонового эфира в моно- и дикарбоновые кислоты. Синтез монокарбоновых кислот Синтез одноосновной кислоты из малонового эфира может быть представлен следующей схемой: H5C2OOC-CH2-COOC2H5 [H5C2OOC-CH-COOC2H5]¯ Na +
[H5C2OOC-CR-COOC2H5]¯ Na + H5C2OOC-CRR’-COOC2H5
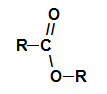
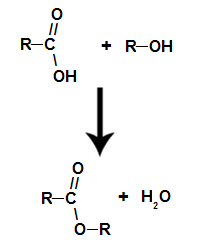
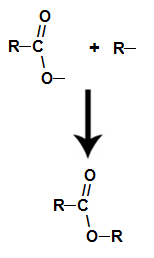
Для решения задачи необходимо представить название целевой кислоты по рациональной номенклатуре как замещённой уксусной, например: диалкилуксусная кислота. Поскольку фрагмент уксусной кислоты в целевой кислоте вносится из малонового эфира, то, следовательно, достроить углеродную цепь до необходимой длины нужно введением соответствующих алкильных группировок Rи R: Реакционная способность галогеналканов в SN-реакциях снижается в рядуR—I > R—Br >R—Cl >R—F, поэтому для алкилирования предпочтительно пользоваться йодидами или бромидами. Синтез дикарбоновых кислот Синтез двухосновных кислот может проводиться тремя методами: а) с использованием двух молей малонового эфира и дигалогенопроизводного. В этом случае целесообразно в синтезируемой дикарбоновой кислоте выделить по два концевых атома углерода, приходящих в неё из малонового эфира, например: Центральная часть углеводородной цепи достраивается с помощью соответствующего дигалогенопроизводного Br–CHR–CHR–Br. Схема синтеза дикарбоновой кислоты из двух молей малонового эфира приобретает следующий вид: 2 H5c2ooc-ch2-cooc2h5 2 [H5C2OOC-CH-COOC2H5]¯ Na + б) с использованием одного моля малонового эфира и эфира -галогенкарбоновой кислоты (этот метод применяется для синтеза -замещённых янтарных кислот). Для решения задачи в конечном соединении выделяется фрагмент уксусной кислоты: Остальная часть углеродной цепи вводится с помощью соответствующего эфира -галогенкарбоновой кислотыBr–CHR–COOC2H5. Тогда схема синтеза целевой кислоты будет следующей: H5C2OOC-CH2-COOC2H5 [H5C2OOC-CH-COOC2H5]¯ Na + в) с использованием двух молей малонового эфира и молекулярного йода (этот метод применяется для синтеза янтарной кислоты и её ,-сим-дизамещённых гомологов). Для этого в целевой дикарбоновой кислоте необходимо выделить по два концевых атома углерода, вводимых в неё из малонового эфира, например: Тогда легко видеть, что прежде чем «сшить» между собой молекулярным йодом два моля натриймалонового эфира, его необходимо проалкилировать, введя радикал R. Следовательно, схема синтеза,–диалкилянтарной кислоты приобретает вид: Источник Что такое эфир?Ты сложные эфиры кислородсодержащие органические соединения, которые образуются в результате химической реакции между карбоновая кислота это алкоголь . Представьте функциональную группу (состоящую из двух атомов кислорода и двух радикалы R) представлен ниже: Общая функциональная группа сложного эфира Конструктивно то, что характеризует сложный эфир это присутствие некоторого алкильного радикала, присоединенного непосредственно к атому кислорода. В этом случае радикал (R), присоединенный к углероду, который, в свою очередь, дважды присоединен к кислороду, может быть либо алкильным радикалом, либо атомом водорода. Углеродная цепь сложного эфира реакция этерификации это о химическая реакция, которая приводит к образованию сложного эфира и молекулы воды в результате взаимодействия карбоновой кислоты и любого спирта, как в приведенном ниже уравнении: Химическое уравнение образования сложного эфира Во время этерификации гидроксильная группа (ОН) спирта взаимодействует с водород (H) ионизируемый из гидроксила кислоты и образует молекула воды. Группы, образующие молекулы воды при этерификации уже сложный эфир он образуется путем связывания радикала (R) спирта с кислородом, который остается от гидроксила кислоты после образования воды. Образование молекулы сложного эфира Характеристики эфиров Основные физические свойства представлены сложные эфиры:
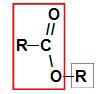
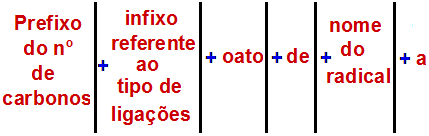
Правило именования сложных эфиров Перед использованием правила именования сложный эфир, важно помнить, что это соединение образовано объединением двух частей, одна из которых карбоновой кислоты (красным) и спирта (синим), как показано на изображении а следить: Идентификация частей, из которых состоит эфир По данным Международного союза теоретической и прикладной химии (ИЮПАК), официальное правило наименования сложного эфира: Правило именования сложных эфиров Примечание: Префикс и инфикс всегда соответствуют части карбоновой кислоты, а радикал — части спирта. См. Ниже несколько примеров применения правила именования сложных эфиров: 1-й пример: малиновая эссенция Структурная формула эфира малиновой эссенции Чтобы назвать этот эфир, мы используем:
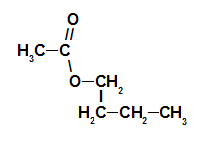
Таким образом, название эфира, соответствующего малиновой эссенции, — бутилэтаноат. 2-й пример: эссенция сосновой шишки Структурная формула эфира сосновой шишки Чтобы сформировать название этого эфира, мы используем:
Таким образом, название эфира, соответствующего эссенции сосновой шишки, — метилбутаноат. 3-й пример: клубничная эссенция Структурная формула Strawberry Essence Ester Чтобы назвать этот эфир, мы используем:
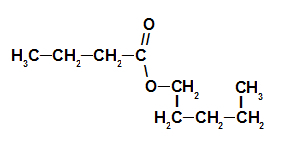
Таким образом, название эфира, соответствующего клубничной эссенции, — пентилбутаноат. Использование сложных эфиров Сложные эфиры хорошо известны своим использованием в качестве ароматизатор в обработанных пищевых продуктах, то есть веществах, имитирующих характерный вкус и аромат натуральных продуктов, например фруктов. Более того, сложные эфиры до сих пор используются в производстве лекарств, косметики, парфюмерии и восков.. Источник: Бразильская школа — https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm Знайте, какой психологический блок мешает вам осуществить свою мечтуВы чувствуете себя немотивированным даже при материальном вознаграждении? Может быть, это они явл. Клиент, попавший в аферу с WhatsApp, получит от Nubank почти 1500 реалов.Клиент Banco do Brasil, который попал в аферу с WhatsApp, решил подать в суд на Nubank, чтобы пол. Приложения для совместного воспитания помогают с опекой над детьми после разводаНовинка в Индия помог родителям организовать опеку над детьми при разводе. Они приложения изсовме. Источник |






 H5C2OOC-CHR-COOC2H5
H5C2OOC-CHR-COOC2H5 
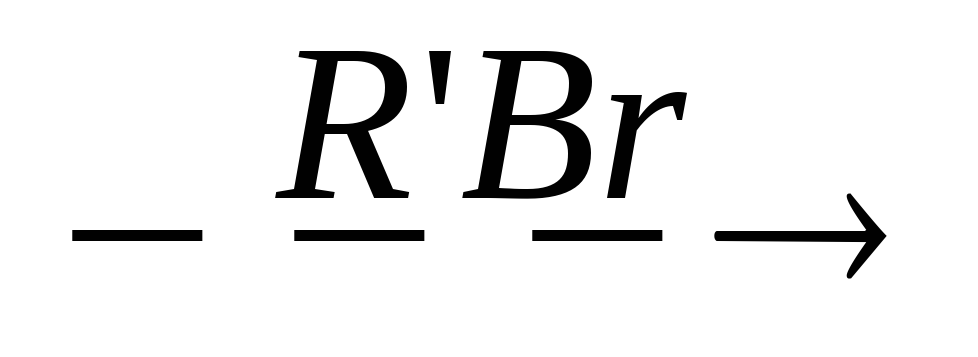
 HOOC-CRR’-COOH
HOOC-CRR’-COOH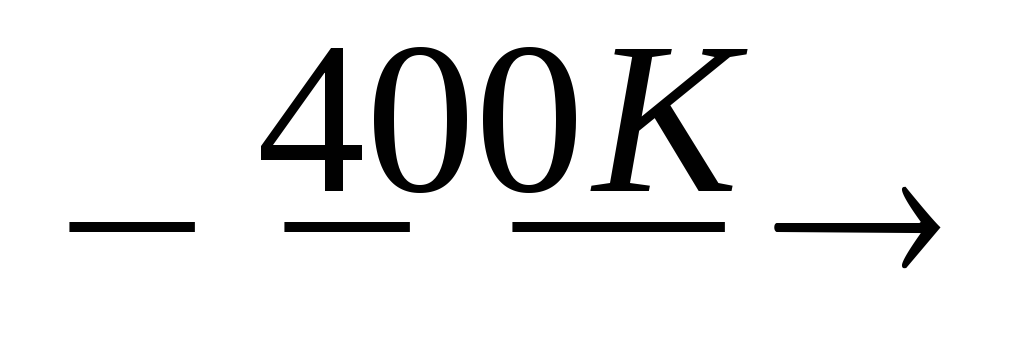 RR’CH-COOH + CO2
RR’CH-COOH + CO2