Лакмус индикатор малиновый цвет
Каждому школьнику хорошо знаком лакмус — с его помощью определяют кислотность среды. Это вещество является кислотно-основным индикатором, т. е. обладает способностью обратимо изменять окраску в зависимости от кислотности раствора: в кислой среде лакмус становится красным, а в щелочной — синим. В нейтральной среде цвет лакмуса фиолетовый — это сочетание равных количеств синего и красного. Хотя лакмус уже в течение нескольких столетий верно служит людям, его состав так до конца и не изучен. В этом нет ничего удивительного: ведь лакмус — это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски — заменителя дорогостоящего пурпура. Затем рецепт приготовления лакмуса оказался утерян. Лишь в начале XIV в. во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.
При переходе от кислой среды к щелочной окраска лакмуса меняется с красной на синюю .
Готовили лакмус из специальных видов лишайников. Измельчённые лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную таким образом густую массу помешали в деревянные бочки, добавляли мочу и выдерживали длительное время. Постепенно раствор приобретал тёмно-синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей. В XVII столетии производство орсейли было налажено во Фландрии и Голландии, а в качестве сырья использовали лишайники, которые привозили с Канарских островов.
Похожее на орсейль красящее вещество было выделено в XVII в. из гелиотропа — душистого садового растения с тёмно-лиловыми цветками.
Знаменитый физик и химик XVII в. Роберт Бойль писал о гелиотропе: «Плоды этого растения дают сок, который при нанесении на бумагу или материю имеет сначала свежий ярко-зелёный цвет, но неожиданно изменяет его на пурпурный. Если материал замочить в воде и отжать, вода окрашивается в винный цвет; такие виды красителя (их обычно называют «турнесоль») есть у аптекарей, в бакалейных лавках и в других местах, которые служат для окраски желе, или других веществ, кто как хочет». С того времени орсейль и гелиотроп стали использовать в химических лабораториях. И лишь в 1 704 г. немецкий учёный М. Валентин назвал эту краску лакмусом.
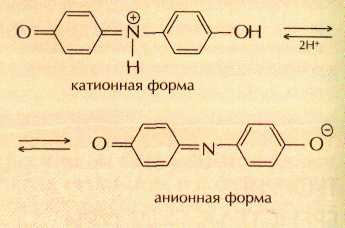
Сегодня для производства лакмуса измельчённые лишайники сбраживают в растворах поташа (карбоната калия) и аммиака, затем в полученную смесь добавляют мел или гипс. Считается, что красящими веществами лакмуса являются индофенолы, которые в кислой среде существуют в катионной форме, а в щелочной — в анионной, например:
В некоторых странах краску, сходную с лакмусом, добывали и из других растений. Простейшим примером служит свекольный сок, который также изменяет цвет в зависимости от кислотности среды.
В сильнокислой среде индикатор метиловый оранжевый имеет красную окраску, в слабокислой и нейтральной — оранжевую, а в щелочной — жёлтую.
Метиловый оранжевый в щелочной среде.
В XIX в. на смену лакмусу пришли более прочные и дешёвые синтетические красители, поэтому использование лакмуса ограничивается лишь грубым определением кислотности среды. Для этой цели служат полоски фильтровальной бумаги, пропитанные раствором лакмуса. В аналитической практике применение лакмуса ограничено тем, что по мере полкисления он изменяет окраску постепенно, а не в узком интервале рН, как многие современные индикаторы. На смену лакмусу в аналитической химии пришёл лакмоид — краситель резорциновый синий, который отличается от природного лакмуса по строению, но сходен с ним по окраске: в кислой среде он красный, а в щелочной — синий.
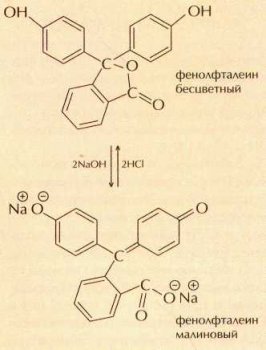
При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины XIX в. С некоторыми из них можно познакомиться в школьной химической лаборатории. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной — оранжевый, а в щелочной — жёлтый. Более яркая цветовая гамма свойственна индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной — жёлтый, а в щелочной — синий. Индикатор фенолфталеин (он продаётся в аптеке под названием «пурген») в кислой и нейтральной среде бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зелёный (сто спиртовой раствор используется как дезинфицирующее средство — «зелёнка»). Для того чтобы проверить это, надо приготовить разбавленный раствор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптечного препарата. Раствор приобретёт красивый зелёно-голубой цвет. В сильнокислой среде его окраска сменится жёлтой, а в сильнощелочной раствор обесцветится.
Однако наиболее часто в лабораторной практике используется универсальный индикатор — смесь нескольких кислотно-основных индикаторов. Он позволяет легко определить не только характер среды (кислая, нейтральная, щелочная), но и значение кислотности (рН) раствора.
Индикатор тимоловый синий в кислой среде имеет малиново-красную, в нейтральной — жёлтую, а в щелочной — синюю окраску
Авторы: Андрей Дроздов, Илья Леенсон, Дмитрий Трифонов, Денис Жилин, Александр Серов, Андрей Бреев, Андрей Шевельков, Вадим Ерёмин, Юлия Яковлева, Оксана Рыжова, Виктория Предеина, Наталья Морозова, Алексей Галин, Сергей Каргов, Сергей Бердоносов, Александр Сигеев, Оксана Помаз, Григорий Середа, Владимир Тюрин, Антон Максимов, Вячеслав Загорский, Леонид Каневский, Александр Скундин, Борис Сумм, Игнат Шилов, Екатерина Менделеева, Валерий Лунин, Абрам Блох, Пётр Зоркий, Александр Кури, Екатерина Иванова, Дмитрий Чаркин, Сергей Вацадзе, Григорий Серела, Анастасия Ростоцкая, Александр Серое, Анастасия Сигеева
Источник
Cреда водных растворов веществ. Индикаторы
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] < [ОН – ] |
| pH < 7 | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник