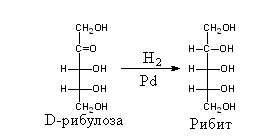4 Таутомерия моносахаридов в растворах
Характерной особенностью моносахаридов является их ярко выраженная способность к таутомерным превращениям. Углеводы были исторически одними из первых веществ, для которых наблюдалось явление таутомерии. Вспомним, что таутомерия — это равновесная, обратимая, самопроизвольная изомерия, т.е. частный случай изомерии. Различают два вида изомерии моносахаридов в растворах :
1) Кето-енольную и 2) кольчато-цепную или оксо-окси-таутомерию.
Кето-енольная таутомерия моносахаридов. Происходит при действии щелочей и состоит в переходе карбонильной формы (альдегидной или кетонной) в енольную форму (точнее ендиольную) с двумя ОН-группами при атомах углерода, связанных двойной связью, т.е. в образовании ендиола общего для эпимерных моносахаридов. Благодаря кето-енольной таутомерии, эпимерные моносахариды могут превращаться друг в друга. Например, в щелочной среде фруктоза претерпевает таутомерное превращение в глюкозу, которая и реагирует с фелинговой жидкостью:
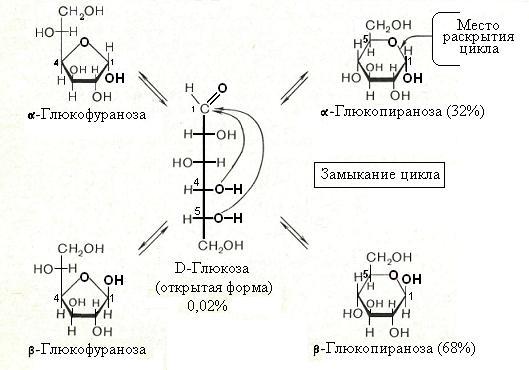
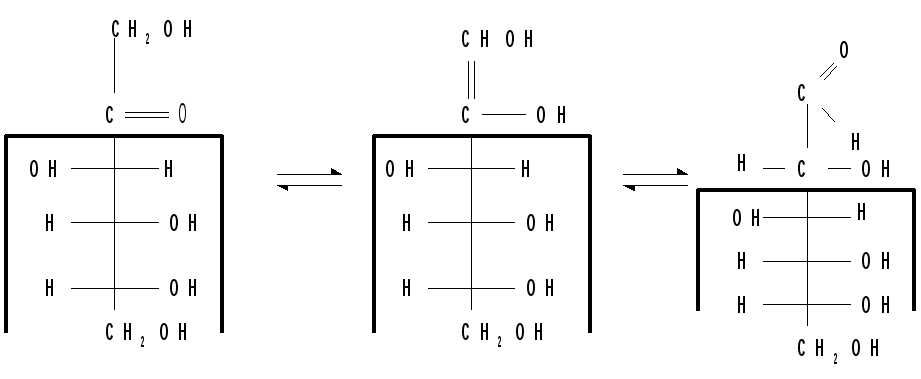
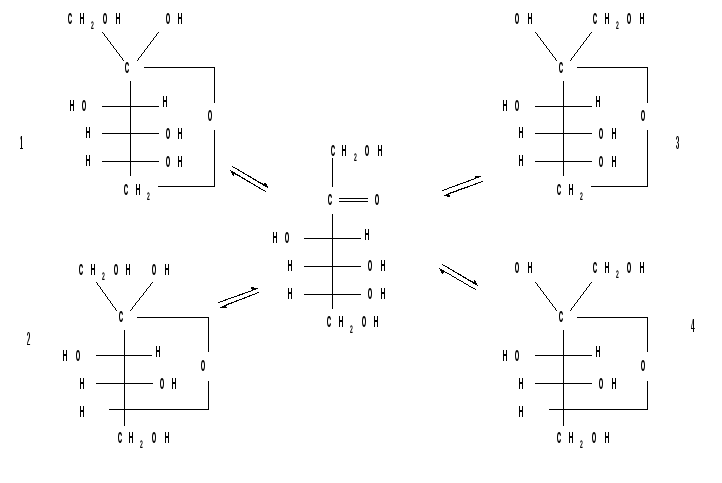
Кольчато- цепная (оксо-окси-) таутомерия моносахаридов. Заключается в существовании кольчатых (циклических) форм и цепной (т.е. с открытой углеродной цепью) формы моносахарида, находящихся в растворе в динамическом равновесии. Обычно циклические формы моносахаридов преобладают над открытой цепной формой. Например, известно, что в водных растворах глюкоза находится, главным образом, в виде - и- глюкопираноз, в меньшей степени — в виде- и-глюкофураноз и совсем небольшое количество глюкозы — в виде открытой, альдегидной формы (0.024 %). В целом пиранозные формы резко преобладают над фуранозными формами.
В растворах установление равновесия между четырьмя циклическими таутомерами моносахаридов протекает через открытую форму — оксо-форму:
В зависимости от условий реакции и примененных реагентов моносахариды реагируют в одной из таутомерных форм : пиранозной, фуранозной или ациклической, оксо-форме, так как расходование одной из них в ходе реакции сдвигает таутомерное равновесии в сторону реагирующей формы. Например, несмотря на незначительное содержание оксо-формы, глюкоза вступает в реакции, характерные для альдегидной группы. Таутомерия лежит в основе множественности химических свойств моносахаридов. Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных дисахаридов. Так, для важнейшего представителя кетогексоз Д-фруктозы схема таутомерных превращений имеет следующий вид:
Мутаротация
Кольчато-цепная таутомерия моносахаридов является причиной любопытного свойства простых углеводов. В кристаллическом состоянии моносахариды находятся только в циклической форме. В зависимости от условий кристаллизуется либо -, либо -форма. Так, при кристаллизации из воды глюкоза получается в виде -Д-глюкопиранозы, а при кристаллизации из пиридина — в виде -Д-глюкопиранозы. После растворения -Д-глюкопиранозы в воде вначале наблюдается характерное для нее значение удельного вращения, равное [] = + 112,2 0 . Однако при стоянии раствора эта величина постепенно снижается и наконец достигает устойчивого значения +52,5 0 . Это явление получило название мутаротации.
Мутаротация — явление самопроизвольного изменения угла вращения плоскости поляризации или изменение оптической активности при стоянии свежеприготовленного раствора сахара. Оно связано с тем, что в растворе устанавливается равновесие между циклическими - и -пиранозными формами, которые переходят друг в друга в результате раскрытия пиранозного цикла с образованием открытой оксо-формы. Следует отметить, что -Д- глюкопираноза имеет удельное вращение равное [] = +19,3 0 , а равновесная смесь обладает средним значением удельного вращения (+ 52,5 0 ) :
— форма 

Взаимопревращение - и-аномеров друг в друга через промежуточную оксо-форму называется аномеризацией.
Конечное значение удельного вращения (+ 52,5 0 ) определяется равновесной смесью этих форм, при этом содержание оксо-формы мало и составляет лишь доли процента. Положение равновесия не зависит от того, из какой таутомерной формы - или - мы исходим.
Источник
Кольчато-цепная таутомерия. Явление мутаротации
Моносахариды представляют собой кристаллы, очень хорошо растворимые в воде. В кристаллической форме они находятся в виде кольца, чаще всего – β-аномера, наиболее термодинамически выгодной формы. При растворении β-кольцо раскрывается, превращаясь в цепную структуру, затем опять образуется кольцо, причём не только β-форма, но и α-форма. В течение некоторого времени между всеми тремя структурами устанавливается равновесие. После установления равновесия в растворе будут присутствовать цепная форма моносахарида (очень немного), β-аномер и α-аномер. Эти три изомера, находящиеся в равновесии, называют таутомерами, а само явление установления равновесия между ними – кольчато-цепной таутомерией. В приведённом ниже примере использована молекула глюкозы.
Рис. 2-9. Кольчато-цепная таутомерия глюкозы
При образовании равновесной таутомерной смеси могут возникать кольцевые формы, различающиеся также размерами цикла (пиранозы и фуранозы). Взаимный переход различных кольцевых структур возможен только через промежуточную, открытую, оксо-форму моносахарида.
В свежеприготовленных растворах моносахаридов кольчато-цепную таутомерию можно наблюдать по явлению мутаротации. Оно заключается в том, что во время установления равновесия между всеми таутомерными формами, происходит изменение угла вращения плоскости поляризации света. Это изменение объясняется тем, что у каждой таутомерной формы угол вращения плоскости поляризации – свой. После установления равновесия угол поворота становится постоянным.
26. Свойства моносахаридов. Проекции Фишера, Хеуорза.
Химические свойства моносахаридов
Реакционная способность углеводов-моносахаридов определяется наличием в их молекуле нескольких реакционных центров.
1. Реакционный центр в оксо-группе.
Примеры реакций нуклеофильного присоединения:
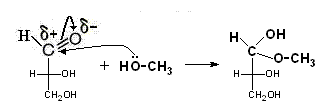
v Взаимодействие со спиртами – образование полуацеталей
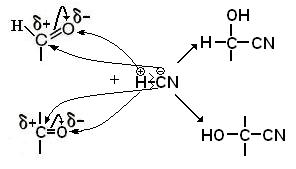
v Взаимодействие с синильной кислотой – образование оксинитрилов
v Реакция восстановления (присоединение водорода) – образование многоатомных спиртов
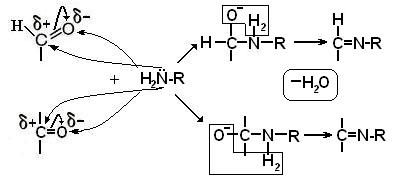
v Взаимодействие с первичными аминами – образование оснований Шиффа
v Реакция с аммиаком – взаимодействие по электрофильному центру атома углерода, соседнего с альдегидгой группой. В результате реакции образуются аминосахара
2. Нуклеофильные центры в спиртовых гидроксилах (реакции нуклеофильного замещения)
Примеры реакций по спиртовым гидроксилам
v Взаимодействие с алкилгалогенидами – образование простых эфиров
v Взаимодействие с кислотами (минеральными и органическими) – образование сложных эфиров
v Внутримолекулярное взаимодействие с карбонильной группой – получение циклических форм моносахаридов (см. выше).
3. Реакции окисления моносахаридов
В альдозах-моносахаридах есть две химические группы, способные окисляться. Первая – это альдегидная группа, которая может окислиться такими слабыми окислителями как бромная вода, реактив Толленса (аммиачный раствор оксида серебра), гидроксид меди (II) или холодный водный раствор перманганата калия.
Рис. 2-10. Схема окисления моносахаридов альдоз
Вторая группа – это концевой спиртовый гидроксил, который можно окислить более сильными окислителями. При этом сначала надо защитить от окисления альдегидную группу. Третий вариант окисления наблюдается при действии сильного окислителя (например, азотной кислоты) на обе окисляемые группы.
Образующиеся при окислении кислоты различаются по названиям. У каждого типа кислоты в названии своё окончание (см. рис. 2-10).
Моносахариды кетозы не окисляются слабыми окислителями (бромная вода и другие), и это их отличает от альдоз.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
4 Таутомерия моносахаридов в растворах
Характерной особенностью моносахаридов является их ярко выраженная способность к таутомерным превращениям. Углеводы были исторически одними из первых веществ, для которых наблюдалось явление таутомерии. Вспомним, что таутомерия — это равновесная, обратимая, самопроизвольная изомерия, т.е. частный случай изомерии. Различают два вида изомерии моносахаридов в растворах :
1) Кето-енольную и 2) кольчато-цепную или оксо-окси-таутомерию.
Кето-енольная таутомерия моносахаридов. Происходит при действии щелочей и состоит в переходе карбонильной формы (альдегидной или кетонной) в енольную форму (точнее ендиольную) с двумя ОН-группами при атомах углерода, связанных двойной связью, т.е. в образовании ендиола общего для эпимерных моносахаридов. Благодаря кето-енольной таутомерии, эпимерные моносахариды могут превращаться друг в друга. Например, в щелочной среде фруктоза претерпевает таутомерное превращение в глюкозу, которая и реагирует с фелинговой жидкостью:
Кольчато- цепная (оксо-окси-) таутомерия моносахаридов. Заключается в существовании кольчатых (циклических) форм и цепной (т.е. с открытой углеродной цепью) формы моносахарида, находящихся в растворе в динамическом равновесии. Обычно циклические формы моносахаридов преобладают над открытой цепной формой. Например, известно, что в водных растворах глюкоза находится, главным образом, в виде - и- глюкопираноз, в меньшей степени — в виде- и-глюкофураноз и совсем небольшое количество глюкозы — в виде открытой, альдегидной формы (0.024 %). В целом пиранозные формы резко преобладают над фуранозными формами.
В растворах установление равновесия между четырьмя циклическими таутомерами моносахаридов протекает через открытую форму — оксо-форму:
В зависимости от условий реакции и примененных реагентов моносахариды реагируют в одной из таутомерных форм : пиранозной, фуранозной или ациклической, оксо-форме, так как расходование одной из них в ходе реакции сдвигает таутомерное равновесии в сторону реагирующей формы. Например, несмотря на незначительное содержание оксо-формы, глюкоза вступает в реакции, характерные для альдегидной группы. Таутомерия лежит в основе множественности химических свойств моносахаридов. Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных дисахаридов. Так, для важнейшего представителя кетогексоз Д-фруктозы схема таутомерных превращений имеет следующий вид:
Мутаротация
Кольчато-цепная таутомерия моносахаридов является причиной любопытного свойства простых углеводов. В кристаллическом состоянии моносахариды находятся только в циклической форме. В зависимости от условий кристаллизуется либо -, либо -форма. Так, при кристаллизации из воды глюкоза получается в виде -Д-глюкопиранозы, а при кристаллизации из пиридина — в виде -Д-глюкопиранозы. После растворения -Д-глюкопиранозы в воде вначале наблюдается характерное для нее значение удельного вращения, равное [] = + 112,2 0 . Однако при стоянии раствора эта величина постепенно снижается и наконец достигает устойчивого значения +52,5 0 . Это явление получило название мутаротации. Мутаротация — явление самопроизвольного изменения угла вращения плоскости поляризации или изменение оптической активности при стоянии свежеприготовленного раствора сахара. Оно связано с тем, что в растворе устанавливается равновесие между циклическими - и -пиранозными формами, которые переходят друг в друга в результате раскрытия пиранозного цикла с образованием открытой оксо-формы. Следует отметить, что -Д- глюкопираноза имеет удельное вращение равное [] = +19,3 0 , а равновесная смесь обладает средним значением удельного вращения (+ 52,5 0 ) : — форма 

Источник