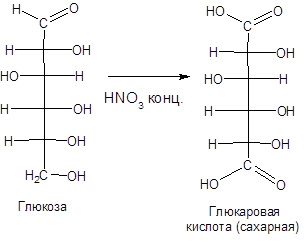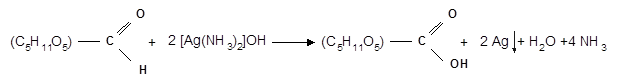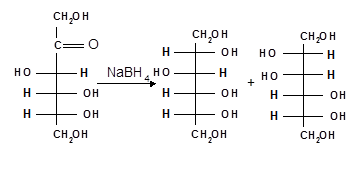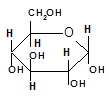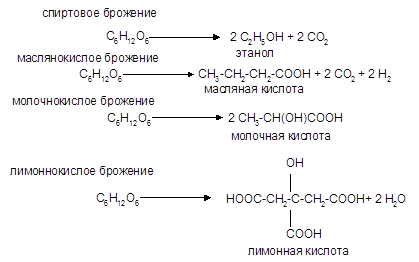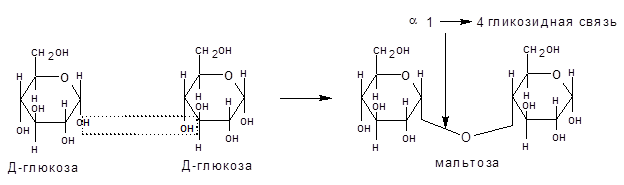- Фруктоза химические свойства реакции
- Химические свойства моносахаридов
- Химические свойства моносахаридов. В соответствии с химическим строением моносахариды могут проявлять свойства карбонильных соединений
- 1. Реакции карбонильных форм моносахаридов
- 2. Реакции с участием гидроксильных групп
- 3. Брожение сахаров
Фруктоза химические свойства реакции
Истинная, эмпирическая, или брутто-формула: C6H12O6
Химический состав Фруктозы
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 6 | 40% |
| Na | Натрий | 22,99 | 12 | 6,7% |
| O | Кислород | 15,999 | 6 | 53,3% |
Молекулярная масса: 180,156
Фруктоза — (арабино-гексулоза, фруктовый сахар) — моносахарид, кетоноспирт, кетогексоза, изомер глюкозы.
В 1861 году Бутлеров синтезировал фруктозу конденсацией муравьиной кислоты в присутствии катализаторов: Ba(OH)2 и Ca(OH)2.
Белое кристаллическое вещество, хорошо растворимое в воде. Температура плавления фруктозы ниже температуры плавления глюкозы. В 2 раза слаще глюкозы и в 4-5 раз слаще лактозы.
В водных растворах фруктоза существует в виде смеси таутомеров, в которой преобладает β-D-Фруктопираноза и содержится, при 20 °C, около 20 % β-D-Фруктофуранозы и около 5 % α-D-Фруктофуранозы: α-D-фруктофураноза — (2R,3S,4R,5R)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
α-L-фруктофураноза — (2S,3R,4S,5S)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
β-D-фруктофураноза — (2S,3S,4R,5R)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
β-L-фруктофураноза — (2R,3R,4S,5S)-2,5-бис(гидроксиметил)оксолан-2,3,4-триол
α-D-фруктопираноза — (2R,3S,4R,5R)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
α-L-фруктопираноза — (2S,3R,4S,5S)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-D-фруктопираноза — (2S,3S,4R,5R)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-L-фруктопираноза — (2R,3R,4S,5S)-2-(гидроксиметил)-оксан-2,3,4,5-тетраол
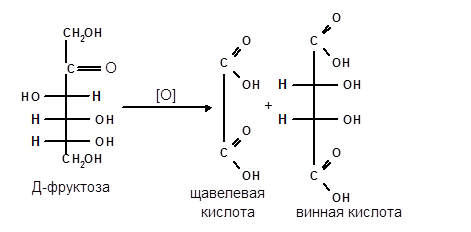
Из водных растворов D-фруктоза кристаллизуется в пиранозной форме (D-фpyктoпиpaнозa) — бесцветных кристаллов, хорошо растворимых в воде, при низких температурах — в виде моно- и полугидратов, выше 21,4 °C — в безводной форме. По своим химическим свойствам фруктоза является типичной кетозой; восстанавливается с образованием смеси маннита и сорбита, с фенилгидразином она образует фенилозазон, идентичный фенилозазонам глюкозы и маннозы. В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щёлочных, так и кислых растворах; разлагается в условиях кислотного гидролиза полисахаридов или гликозидов. Начальной стадией разложения фруктозы в присутствии кислот является дегидратация её фуранозной формы с образованием 5-метилолфурфурола, на чём основана качественная реакция на фруктозу в присутствии резорцина — проба Селиванова: Фруктоза окисляется KMnO4 в кислой среде, образуя щавелевую кислоту и винную кислоту.
Фруктоза и пищевой сахар
Молекула сахарозы (пищевого сахара) состоит из двух простых сахаридов: глюкозы и фруктозы. В организме сахароза расщепляется на глюкозу и фруктозу. Поэтому по своему действию сахароза эквивалентна смеси 50 % глюкозы и 50 % фруктозы.
В живых организмах обнаружен исключительно D-изомер фруктозы. В свободном виде фруктоза присутствует почти во всех сладких плодах, а так же составляет до 80 % мёда, в качестве моносахаридного звена входит в состав сахарозы и лактулозы.
- Вы здесь:
- Главная
- Химические формулы
- Ф
- Формула Фруктозы структурная химическая
Источник
Химические свойства моносахаридов
Химическое свойства моносахаридов определяется присутствием в их молекулах оксогруппы и спиртовых гидроксилов.
Расмотрим на примере глюкозы некоторые реакции моносахаридов.
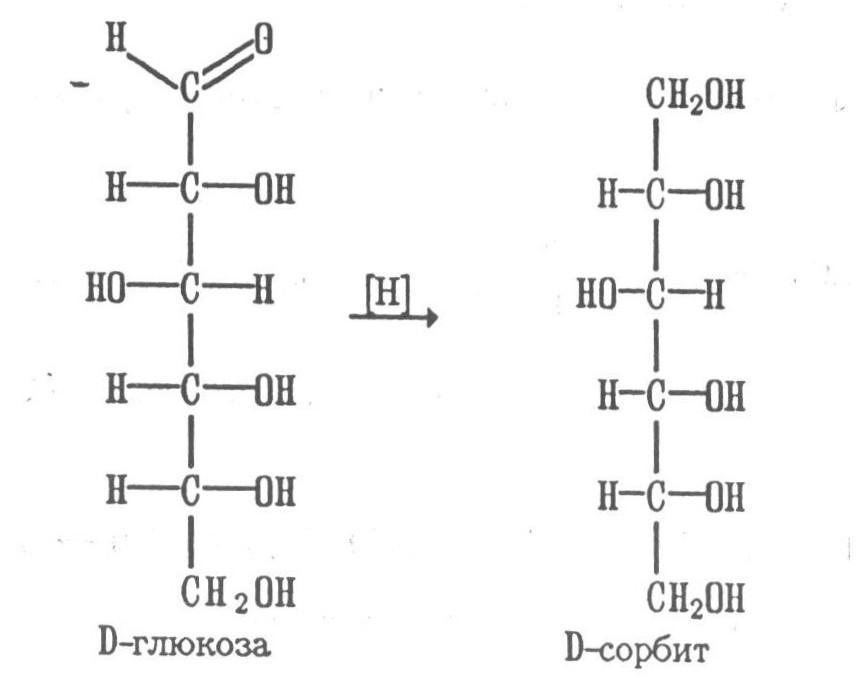
- Восстановление. Все моносахариды, подобно альдегидам и кетонам при восстановлении образуют спирты. При восстановлении гексоз образуются шестиатомный спирты – гекситы. Так, D – глюкоза при это переходит в шестиатомный спирт – D – сорбит:
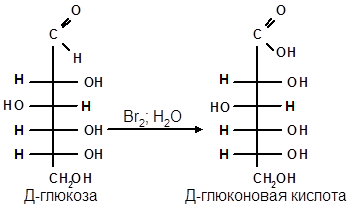
- Окисление. В зависимости от характера окислителя могут образовываться одноосновные (альдоновые) или двуосновные (сахарные) гидроксикислоты. Так, при окислении глюкозы образуются:


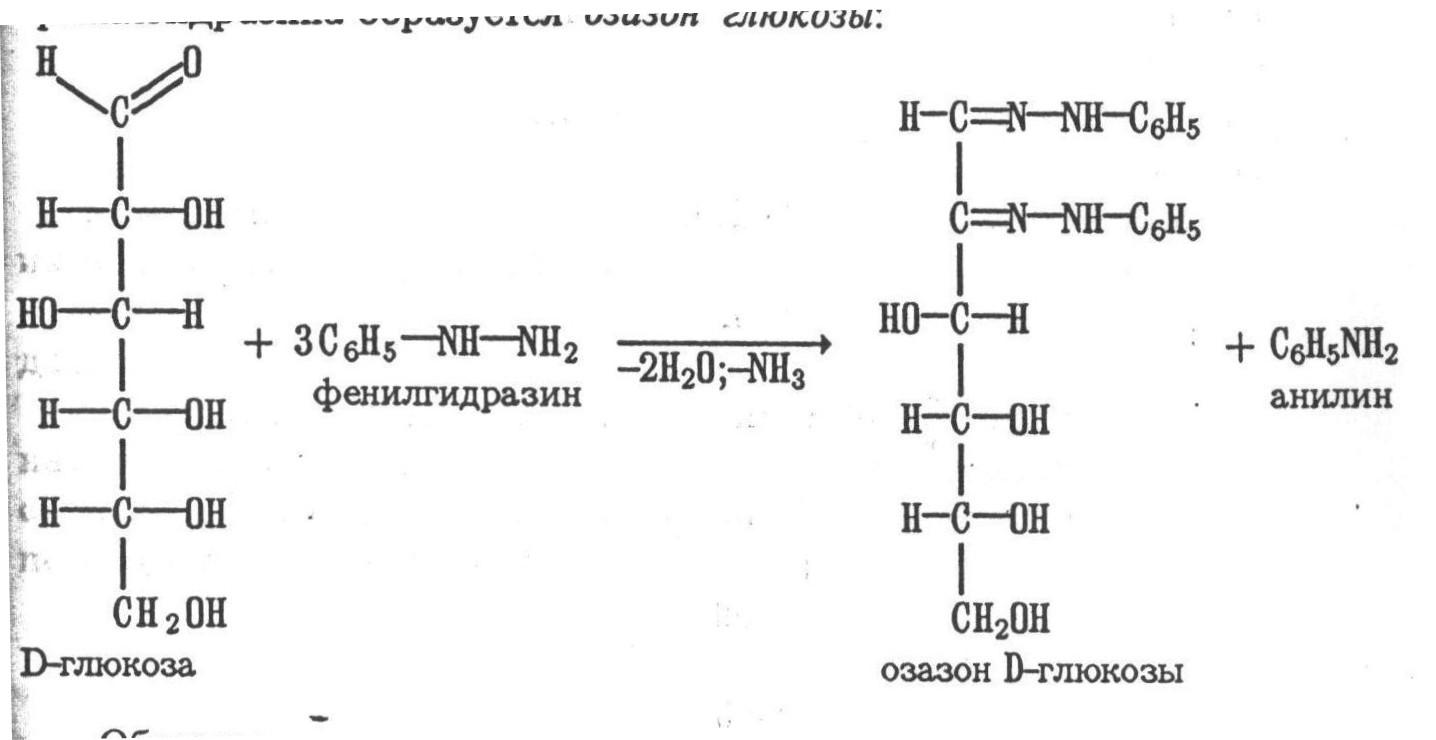
- Образование озазонов. При нагревании глюкозы с избытком фенилгидразина образуется озазон глюкозы:
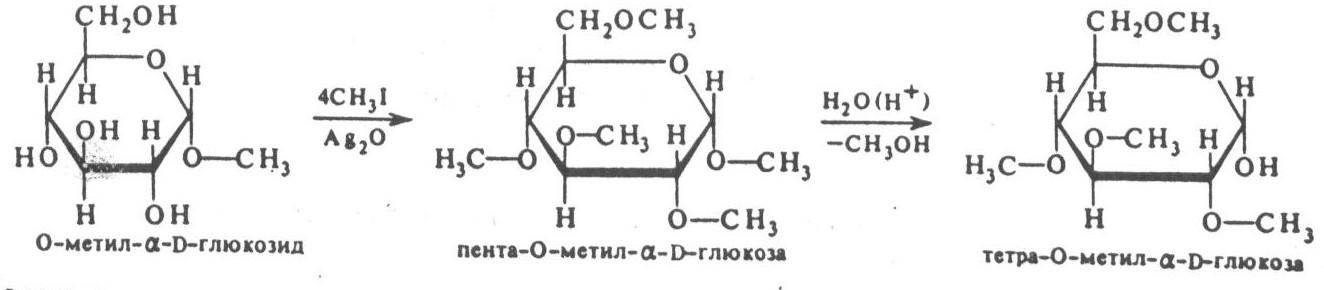
- Реакции алкилирования. Действие алкилирующих агентов на моносахариды, например глюкозу, приводит к образованию неполных и полных простых эфиров. При этом наиболее активно взаимодействует полуацетальный гидроксил. В результате образуется простой эфир – гликозид ( в случае глюкозы – глюкозид). Связь алкила с углеродом (через кислородный мостик) называют гликозидной (гликозидной) связью:
Реакция алкилирования идет в присутствии кислого катализатора (газообразный HCl). Если образовавшийся глюкозид ввести в реакцию с C

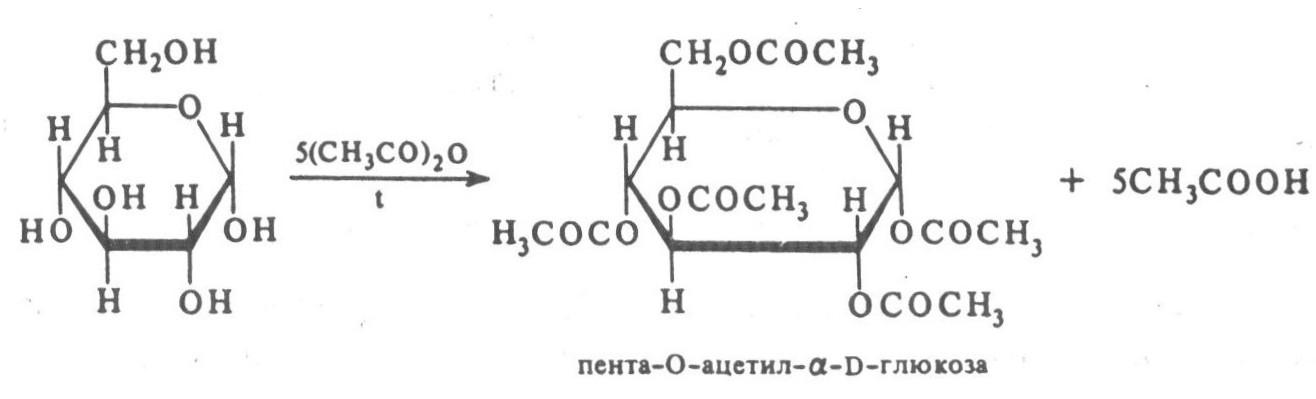
- Реакция ацилирования. В результате таких реакции образуется сложный эфиры. Например, при нагревании уксусного ангидрида с глюкозой образуется пента-О-ацетилглюкоза:
6. Спиртовое брожение. Этот процесс протекает под влиянием различных микроорганизмов. В результате спиртового брожения гексоз (для пентоз эта реакция не характерна) образуеттся этиловый спир:
Источник
Химические свойства моносахаридов. В соответствии с химическим строением моносахариды могут проявлять свойства карбонильных соединений
В соответствии с химическим строением моносахариды могут проявлять свойства карбонильных соединений, спиртов и полуацеталей. Поскольку циклические и открытые формы моносахаридов в растворе находятся в равновесии друг с другом, то расходование одной из них в ходе реакции сдвигает таутомерное равновесие в сторону реагирующей формы. Рассматривая различные реакции моносахаридов, мы будем приводить формулу лишь той таутомерной формы, которая непосредственно участвует в данной реакции.
1. Реакции карбонильных форм моносахаридов
а) Окисление. Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов. Монозы легко окисляются, причем в зависимости от условий окисления образуются различные продукты.
Пример окисления глюкозы:
С помощью сильного окислителя — концентрированной азотной кислоты — концевые группы альдоз (альдегидная и первичноспиртовая) одновременно окисляются в карбоксильные группы, образуя гликаровые кислоты (называемые также сахарными):
Кетозы не окисляются слабыми окислителями. При действии сильных окислителей происходит расщепление молекул. Так, например, при окислении фруктозы получаются винная и щавелевая кислоты:
Слабые окислители в щелочной среде (аммиачный раствор оксида серебра, соединения Сu 2+ ) превращают монозы в сложную смесь продуктов окисления и служат для качественного и количественного определения альдоз и кетоз.
Подобно обычным альдегидам, альдозы легко дают реакцию “серебряного зеркала” с аммиачным раствором оксида серебра (реактив Толленса):
Кетозы тоже способны восстанавливать катионы металлов, так как они в щелочной среде изомеризуются в альдозы.
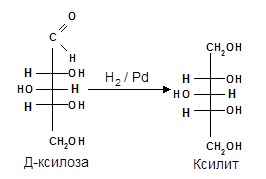
б) Восстановление. При восстановлении моноз образуются многоатомные спирты, называемые альдитами (глицитами). Эти кристаллические, легко растворимые в воде вещества обладают сладким вкусом и часто используются как заменители сахара (ксилит, сорбит).
Простейшим сахароспиртом является трехатомный спирт глицерин, образующийся при восстановлении глицеральдегида. Глюкоза при восстановлении дает шестиатомный сахароспирт сорбит, галактоза – дульцит, манноза – манит:
Сорбит часто встречается в различных фруктах, ягодах: в рябине, сливах, абрикосах, вишнях и др. Дульцит содержится во многих растениях, выделяется на поверхности коры деревьев. Манит содержится в бурых водорослях; плодах (ананас), овощах (морковке, луке).
Восстановление моносахаридов проводят водородом в присутствии металлических катализаторов (палладий, никель).
Шестиатомные спирты — глюцит (сорбит), дульцит и маннит — получаются при восстановлении соответственно глюкозы, галактозы и маннозы. Восстановление глюкозы в сорбит является одной из стадий промышленного синтеза аскорбиновой кислоты.
При восстановлении альдоз получается лишь один полиол, кетоз — смесь двух полиолов, например, при восстановлении Д-фруктозы борогидридом натрия NaBН4 образуются Д- глюцит (сорбит) и Д-маннит:
| Д-фруктоза | Д-глюцит | Д-маннит |
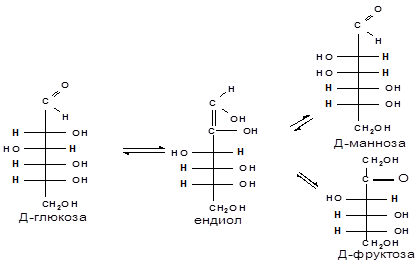
в) Действие щелочей. В разбавленных растворах щелочей при комнатной температуре происходит изомеризация моносахаридов, т.е. получение из одного моносахарида равновесной смеси моноз, отличающихся конфигурацией первого и второго атомов углерода.
Так, водный раствор Д-глюкозы после добавления к нему известковой воды через пять суток имеет состав: Д-глюкозы — 63,5 %, Д-маннозы — 2,5 % и Д-фруктозы — 31 %. Процесс изомеризации проходит через стадию образования промежуточного продукта — ендиола, который для глюкозы, маннозы и фруктозы является общим:
2. Реакции с участием гидроксильных групп
Гидроксильные группы имеются в открытых и циклических формах моноз, но содержание циклических форм значительно выше, поэтому реакции идут в циклических (полуацетальных) формах:
Гидроксилы отличаются по реакционной способности: С1-ОН-гликозидный (наиболее реакционноспособный); С6 — первичный; С2-С4 — вторичные.
2.1 Реакции с участием гликозидного гидроксила
При взаимодействии моносахаридов с гидроксилсодержащими соединениями (спиртами, фенолами и др.) в условиях кислотного катализа образуются производные только по гликозидной ОН-группе — циклические ацетали, называемые гликозидами. Cпиртовые гидроксилы моноз в этих условиях не реагируют.
Удобным способом получения гликозидов является пропускание газообразного хлороводорода (катализатор) через раствор моносахарида в спиртах, например, этаноле, метаноле и т.д. При этом соответственно получаются этил- или метилгликозиды. В названии гликозидов указываются сначала наименования введенного радикала, затем конфигурация аномерного центра и название углеводного остатка с суффиксом — озид.
3. Брожение сахаров
Брожение — это сложный процесс расщепления моносахаридов с выделением СО2 под действием ферментов. Брожению подвергаются сахара, у которых число атомов углерода кратно трем (гексозы).
Брожение гексоз различной конфигурации происходит с неодинаковой легкостью. Существуют и другие виды брожения.
Процессы брожения сахаров играют важную роль и широко используются в промышленности.
Различают разные виды брожения:
Гликозидная связь имеет очень важное биологическое значение. С помощью этой связи осуществляется ковалентное связывание моносахаридов в составе олиго- и полисахаридов:
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник