- Строение и химические свойства угдеводов
- Напишите пожалуйста реакцию фруктозы с Гидроксидом меди (двухвалентным)?
- Напишите уравнения реакции разложения при нагревании : а)гидроксида алюминия?
- C6H12O6 + 2Cu(OH)2 (фруктоза + гидроксид меди) = ?
- Напишите уравнение химической реакции : при нагревании гидроксид меди(II) разлагается на оксид меди (II) и воду?
- Осуществиет цепочку превращений : гидроксид меди(2), оксид меди(2), хлорид меди(2), гидроксид меди(2) Напишите уравнения реакций и укажите, к какому типу реакций относится каждая из них?
- Напишите уравнения реакции разложения гидроксида меди 2 , гидроксида железа 3, гидроксида алюминия,?
- Помогите пожалуйста?
- Напишите уравнение реакций разложения : гидроксида меди (2), гидроксида железа(3), гидроксида алюминия?
- Даны вещества : нитрат серебра, сульфат цинка, медь, гидроксид натрия, раствор серной кислоты?
- Напишите пожалуйста уравнение реакции гидроксида калия с раствором хлорида меди?
- Напишите уравнение реакции, при нагревании не растворимые основания разлагается на оксиды и воду Гидроксид железа 2 Гидроксид меди 1 Гидроксид меди 2 Гидроксид алюминия?
- Лабораторная работа №4 Качественные реакции на углеводы
- Реакция Троммера
- Реакция Фелинга
Строение и химические свойства угдеводов
Опыт 1. Действие аммиачного раствора гидроксида серебра на глюкозу
Условия выполнения работы:
В пробирку налили немного раствора глюкозы и аммиачного раствора оксида серебра. Пробирку нагрели. Наблюдаем осаждение серебра на дне пробирки и стенках пробирки:
В реакцию серебряного зеркала вступает только линейная форма глюкозы.
Опыт 2. Действие гидроксида меди (II) на глюкозу
Условия выполнения работы:
а) В пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса. Наблюдаем образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет. Далее раствор в пробирке нагревается. Реакция глюкозы с гидроксидом меди при нагревании демонстрирует восстановительные свойства глюкозы. Происходит изменение — окрашивания раствора. В начале выпадает осадок оксида меди CuO желтого цвета. В процессе дальнейшего нагревания CuO восстанавливается до оксида меди (I) – Cu2O, который выпадает в виде красного осадка. В процессе этой реакции глюкоза окисляется до глюконовой кислоты.
Таким образом, при нагревании реакция глюкозы с гидроксидом меди(II) идет с восстановлением двухвалентной меди Cu (II) до одновалентной меди Cu (I).
Уравнениия реакций можно представить так:
Происходит качественная реакция на многоатомные спирты, коим является глюкоза, реакция обусловлена наличием гидроксильной группы.
б) Если в пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса, но не нагревали, то будем наблюдать образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет (образуется растворимая комплексная соль). В пробирку к полученному раствору добавили немного воды, закрепили пробирку на штативе. Нагрели пробирку так, чтобы прогревалась только верхняя часть раствора. Наблюдаем выпадение жёлто-красного осадка и обесцвечивание раствора.
При нагревании происходит окисление глюкозы гидроксидом меди до карбоновой кислоты, эта реакция обеспечивается альдегидной группой . Жёлто-красный осадок представляет собой смесь CuOH и Cu2O, образующихся в результате этой реакции.
Выводы:
1) глюкоза реагирует с гидроксидом меди без нагревания с образованием ярко-синего раствора комплексной соли Cu 2+ ;
2) если реакцию глюкозы с гидроксидом меди проводить при нагревании, то происходит окисление глюкозы до карбоновой кислоты, образуется жёлто-красный осадок .
Опыт 3. Действие аммиачного раствора оксида серебра на сахарозу
Условия выполнения работы:
а) В пробирку налили немного раствора сахарозы и немного аммиачного раствора оксида серебра и нагрели пробирку. Ничего не происходит, реакция не идёт, так как сахарозу образуют циклические формы глюкозы и фруктозы, а они не дают реакцию серебряного зеркала.
б) В пробирку налили немного раствора сахарозы и несколько капель разбавленной серной кислоты. Пробирку нагрели. Затем добавили в пробирку раствор гидроксида натрия, доводим раствор до слабощелочной среды (используя как индикатор лакмусовую бумагу). К полученному раствору добавили 2 мл аммиачного раствора оксида серебра и опять нагрели пробирку.
При нагревании раствора сахарозы с несколькими каплями серной кислоты, образуется глюкоза и фруктоза в свободной линейной форме:
Так как при гидролизе сахарозы образуется фруктоза и глюкоза, то реакция серебряного зеркала возможна только при линейной форме глюкозы (Смотри уравнение в Опыте 1.).
Опыт 4. Действие иода на крахмал
Условия выполнения работы:
В химический стакан налили 20 мл кипящей воды и присыпали немного крахмала, образовавшуюся смесь перемешали до образования прозрачного коллоидного раствора — крахмального клейстера. В пробирку налили немного охлаждённого клейстера и добавили несколько капель спиртового раствора иода. Наблюдаем синее окрашивание раствора. При нагревании полученного раствора синее окрашивание исчезает.
- Вы здесь:
- Главная
- Химия
- О.С. Габриелян-10кл
- Практическая работа № 6. «Углеводы»
Источник
Напишите пожалуйста реакцию фруктозы с Гидроксидом меди (двухвалентным)?
Напишите пожалуйста реакцию фруктозы с Гидроксидом меди (двухвалентным).
В молекуле глюкозы есть альдегидная группа, поэтому глюкоза дает реакцию серебряного зеркала(вложение 1)
реагирует и с оксидом серебра в аммиаке, и с гидроксидом меди,
В молекуле фруктозы альдегидной группы нет , поэтому реакцию серебряного зеркала фруктоза не дает.
Фруктоза тоже растворяет гидроксид меди, давая синее окрашивание, но в отличие от глюкозы не дает при нагревании красно — оранжевый осадок оксида меди (I).
Напишите уравнения реакции разложения при нагревании : а)гидроксида алюминия?
Напишите уравнения реакции разложения при нагревании : а)гидроксида алюминия.
Б)гидроксида меди(II)в)гидроксида меди(I)гидроксида железа(III).
C6H12O6 + 2Cu(OH)2 (фруктоза + гидроксид меди) = ?
C6H12O6 + 2Cu(OH)2 (фруктоза + гидроксид меди) = ?
Напишите уравнение химической реакции : при нагревании гидроксид меди(II) разлагается на оксид меди (II) и воду?
Напишите уравнение химической реакции : при нагревании гидроксид меди(II) разлагается на оксид меди (II) и воду.
Осуществиет цепочку превращений : гидроксид меди(2), оксид меди(2), хлорид меди(2), гидроксид меди(2) Напишите уравнения реакций и укажите, к какому типу реакций относится каждая из них?
Осуществиет цепочку превращений : гидроксид меди(2), оксид меди(2), хлорид меди(2), гидроксид меди(2) Напишите уравнения реакций и укажите, к какому типу реакций относится каждая из них.
Напишите уравнения реакции разложения гидроксида меди 2 , гидроксида железа 3, гидроксида алюминия,?
Напишите уравнения реакции разложения гидроксида меди 2 , гидроксида железа 3, гидроксида алюминия,.
Помогите пожалуйста?
Напишите уравнения реакций разложения при нагревании а)гидроксида меди(2), б)гидроксида железа(3) в) гидроксида алюминия.
Напишите уравнение реакций разложения : гидроксида меди (2), гидроксида железа(3), гидроксида алюминия?
Напишите уравнение реакций разложения : гидроксида меди (2), гидроксида железа(3), гидроксида алюминия.
Даны вещества : нитрат серебра, сульфат цинка, медь, гидроксид натрия, раствор серной кислоты?
Даны вещества : нитрат серебра, сульфат цинка, медь, гидроксид натрия, раствор серной кислоты.
Получите в две стадии гидроксид меди 2(двухвалентной).
Напишите уравнения реакций.
Напишите пожалуйста уравнение реакции гидроксида калия с раствором хлорида меди?
Напишите пожалуйста уравнение реакции гидроксида калия с раствором хлорида меди.
Напишите уравнение реакции, при нагревании не растворимые основания разлагается на оксиды и воду Гидроксид железа 2 Гидроксид меди 1 Гидроксид меди 2 Гидроксид алюминия?
Напишите уравнение реакции, при нагревании не растворимые основания разлагается на оксиды и воду Гидроксид железа 2 Гидроксид меди 1 Гидроксид меди 2 Гидроксид алюминия.
Вы находитесь на странице вопроса Напишите пожалуйста реакцию фруктозы с Гидроксидом меди (двухвалентным)? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 — — — — — — — — — — — — — — — — — — — — — — — — — — — — — V(NH3) — ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % — — — — — — — — — — — — — — — — E — ? Е — это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 — это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2023. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Источник
Лабораторная работа №4 Качественные реакции на углеводы
Многие качественные реакции углеводов основаны на восстанавливающих свойствах свободных карбонильных групп (свободного гликозидного гидроксила) сахаров. Эти же реакции применяются для большинства количественных методов определения углеводов.
Моносахариды обладают свойствами как спиртов, так и карбонильных соединений. При восстановлении карбонильной группы металлами (серебро, медь, висмут, железо и др.) в щелочной среде образуются многоатомные спирты. При окислении в первую очередь окисляется карбонильная группа, превращаясь в карбоксильную, а затем возможно окисление спиртовых гидроксилов. Металлы при этих реакциях восстанавливаются из окисной формы в закисную или даже до свободного состояния. На способности моносахаридов восстанавливать различные соединения основаны методы качественного и количественного определения моносахаридов.
Фруктоза также дает реакции восстановления металлов, хотя она имеет не альдегидную, а кетонную группу, которой не свойственно окисляться слабыми окислителями. Это объясняется тем, что в щелочной среде фруктоза легко превращается в глюкозу, которая и проявляет восстанавливающие свойства.
Определение содержания глюкозы в крови и обнаружение ее в моче играет важную роль в клиническом исследовании.
Дисахариды, имеющие свободный глюкозидный гидроксил (мальтоза, лактоза, целлобиоза), дают реакции восстановления металлов. Дисахариды сахароза и трегалоза, не имеющие свободного глюкозидного гидроксила, не дают этих реакций.
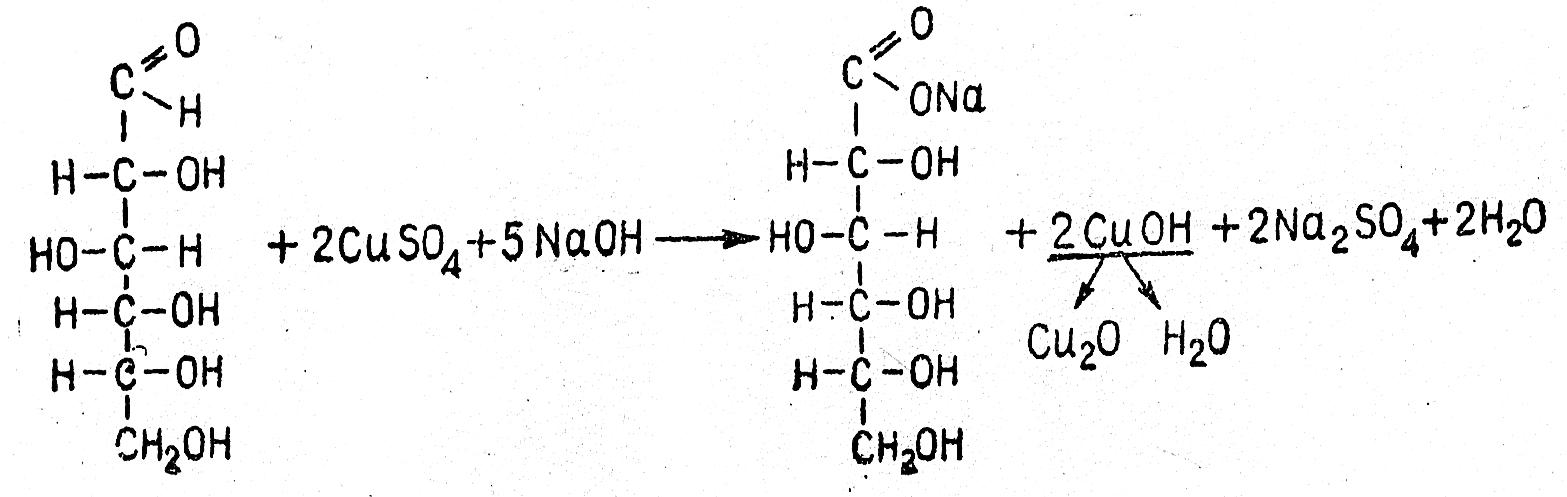
Реакция Троммера
Реакция обусловлена окислением моносахарида и восстановлением гидрата окиси меди в гидрат закиси или закись меди. Схематично реакция может быть изображена следующим образом:
- Глюкоза, 1% раствор.
- Фруктоза, 1% раствор.
- Сахароза, 1% раствор.
- Мальтоза, 1% раствор.
- Гидроксид натрия, 10% раствор.
- Сульфат меди, 5% раствор.
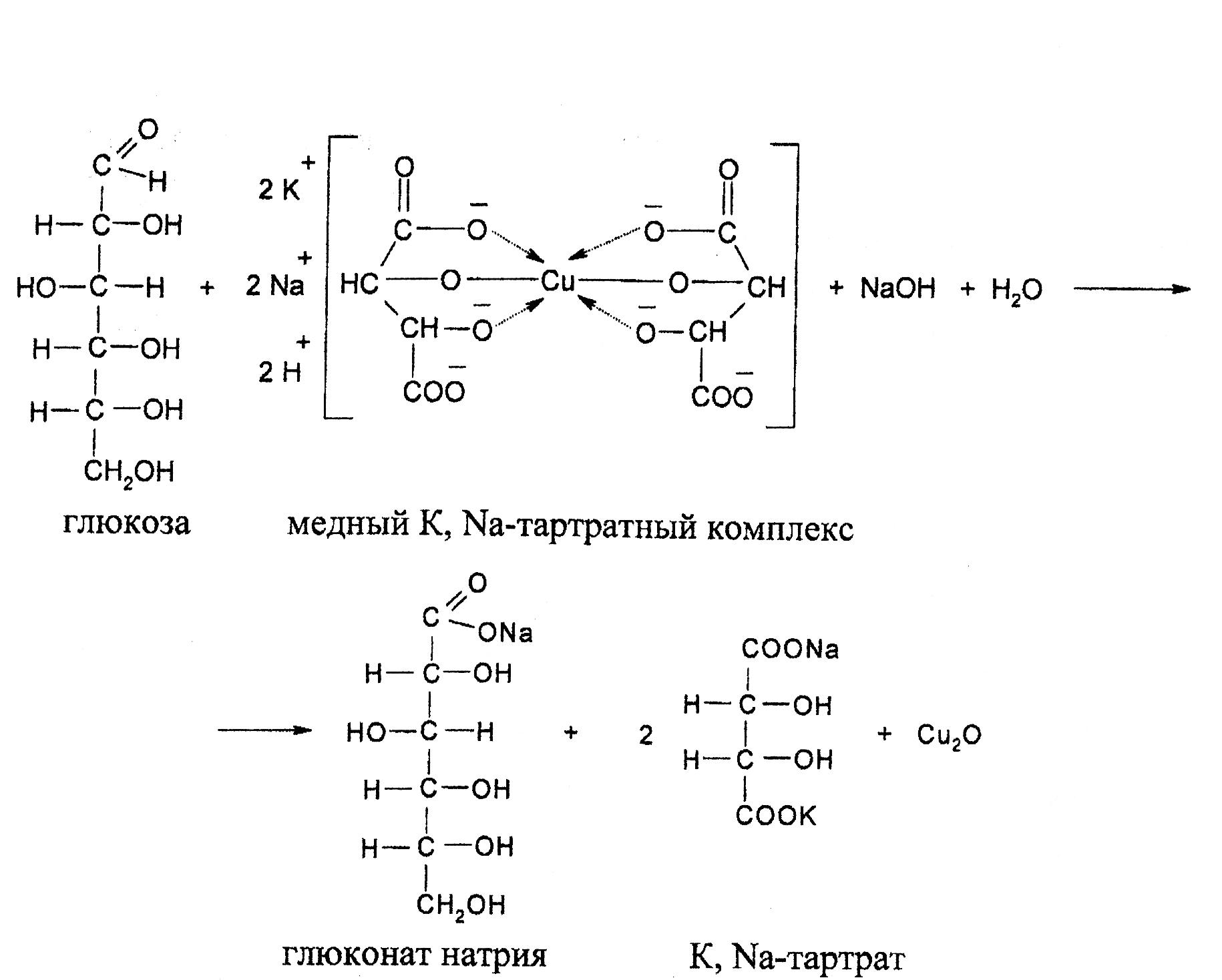
Реакция Фелинга
Реакция Фелинга является модификацией реакции Троммера, в которой вместо Cu(OH)2 применяется алкоголят меди с сегнетовой солью (K, Na-виннокислый) в щелочной среде. Химизм реакции тот же, что и в реакции Троммера. Преимуществом фелинговой жидкости является то, что медь при избытке реактива не выпадает в осадок в виде оксида меди (II). Раствор Фелинг I представляет собой приблизительно 7% водный раствор СuSO4. 5H2O. Раствор Фелинг II представляет собой раствор сегнетовой соли в едкой щелочи. При сливании растворов I и II образуется растворимая медная комплексная соль типа алкоголята меди синего цвета. Алкоголяты меди при нагревании разрушаются в присутствии моносахаридов с образованием алкоголятов сахара с последующим их разрушением. Реактивы:
- Глюкоза, 1% раствор.
- Фруктоза, 1% раствор.
- Сахароза, 1% раствор.
- Мальтоза, 1% раствор.
- Раствор Фелинга.
Проведение опыта В пробирку наливают 1 мл раствора глюкозы и добавляют равный объем реактива Фелинга. Смесь нагревают на спиртовке до кипения. Образовавшийся красный осадок оксида меди (I) свидетельствует о положительной реакции на реактив Фелинга. Проделать реакцию Фелинга с фруктозой, сахарозой, мальтозой.
Источник