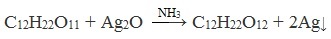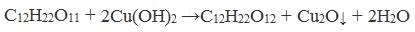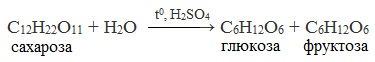Фруктоза cu oh 2 признак
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
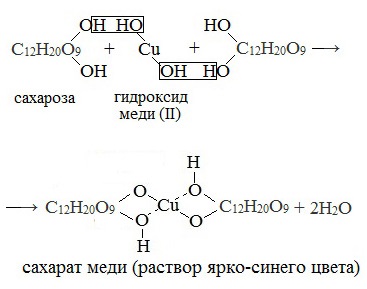
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
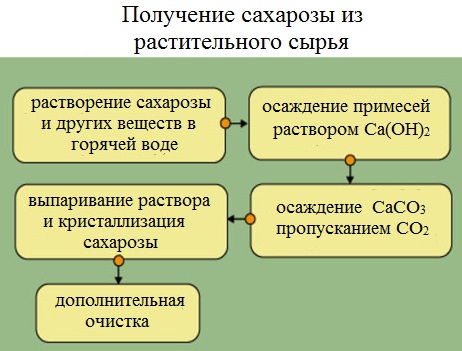
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).


Источник
Фруктоза cu oh 2 признак
- Дисциплина: Химия
- Номер вопроса в билете: 25
- Баллы: 2
- Сложность: Повышенный
- А) бутан и бутен-1
- Б) пропанол-2 и глицерин
- В) пропанол-2 и муравьиная кислота
- Г) фруктоза (р-р) и глюкоза (р-р)
- 1) Сu(ОН)2
- 2) Вr2(р-р)
- 3) С2Н5ОН
- 4) NaCl
- 5) H2SO4
- Войти в свой аккаунт
- Химия
- Биология
- Русский язык
- Математика базовая
- Математика профильная
- Глюкоза, 1% раствор.
- Фруктоза, 1% раствор.
- Сахароза, 1% раствор.
- Мальтоза, 1% раствор.
- Гидроксид натрия, 10% раствор.
- Сульфат меди, 5% раствор.
- Глюкоза, 1% раствор.
- Фруктоза, 1% раствор.
- Сахароза, 1% раствор.
- Мальтоза, 1% раствор.
- Раствор Фелинга.
- ФОРМУЛЫ ВЕЩЕСТВ
- РЕАГЕНТ
C u X 2 O + H X 2 O H X 2 C O X 3
C O X 2 ↑ + H X 2 O
Образуется желтый осадок CuOH который затем переходит в красные кристаллы CuO2. Еще один признак, это образование пузырьков газа от разложения угольной кислоты.
4. Фруктоза и глюкоза
4. фруктоза (р-р) и глюкоза (р-р) Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Поэтому возможно окисление альдегидной группы до кислоты. В молекуле фруктозы альдегидной группы нет, поэтому таких реакций фруктоза не даст. Какие окислительные реакции возможны? Серебряное зеркало, с аммиачным раствором оксида серебра
2 C u O H → C u X 2 O + H X 2 O \ce < 2CuOH ->Cu2O + H2O> 2 C u O H
Источник
Лабораторная работа №4 Качественные реакции на углеводы
Многие качественные реакции углеводов основаны на восстанавливающих свойствах свободных карбонильных групп (свободного гликозидного гидроксила) сахаров. Эти же реакции применяются для большинства количественных методов определения углеводов.
Моносахариды обладают свойствами как спиртов, так и карбонильных соединений. При восстановлении карбонильной группы металлами (серебро, медь, висмут, железо и др.) в щелочной среде образуются многоатомные спирты. При окислении в первую очередь окисляется карбонильная группа, превращаясь в карбоксильную, а затем возможно окисление спиртовых гидроксилов. Металлы при этих реакциях восстанавливаются из окисной формы в закисную или даже до свободного состояния. На способности моносахаридов восстанавливать различные соединения основаны методы качественного и количественного определения моносахаридов.
Фруктоза также дает реакции восстановления металлов, хотя она имеет не альдегидную, а кетонную группу, которой не свойственно окисляться слабыми окислителями. Это объясняется тем, что в щелочной среде фруктоза легко превращается в глюкозу, которая и проявляет восстанавливающие свойства.
Определение содержания глюкозы в крови и обнаружение ее в моче играет важную роль в клиническом исследовании.
Дисахариды, имеющие свободный глюкозидный гидроксил (мальтоза, лактоза, целлобиоза), дают реакции восстановления металлов. Дисахариды сахароза и трегалоза, не имеющие свободного глюкозидного гидроксила, не дают этих реакций.
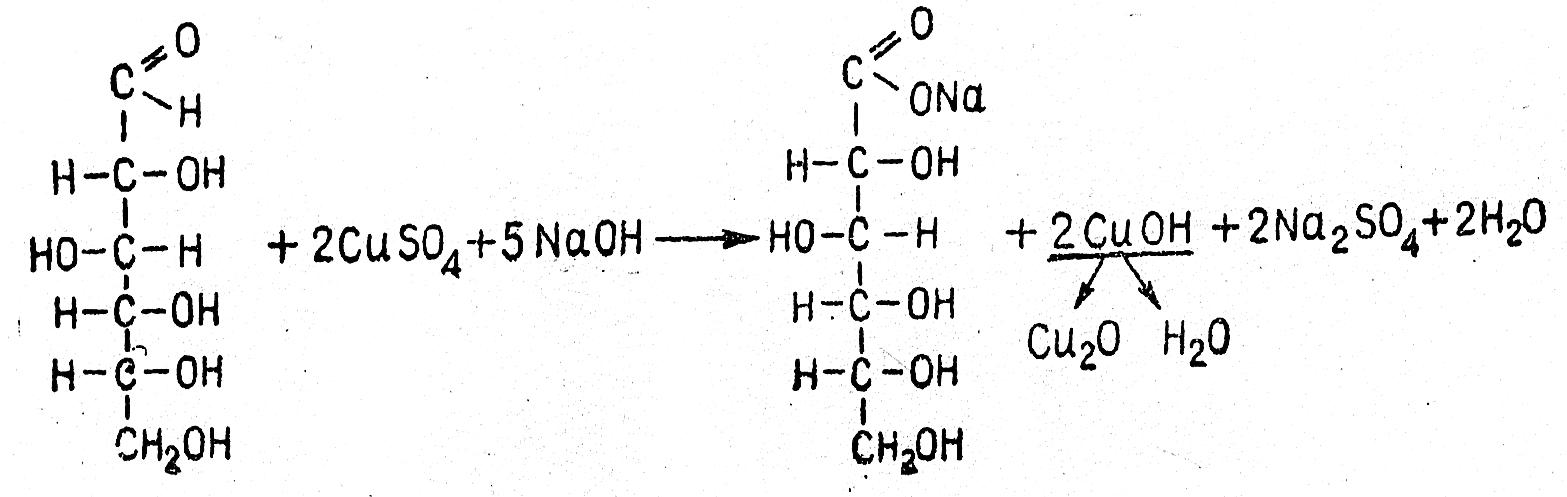
Реакция Троммера
Реакция обусловлена окислением моносахарида и восстановлением гидрата окиси меди в гидрат закиси или закись меди. Схематично реакция может быть изображена следующим образом:
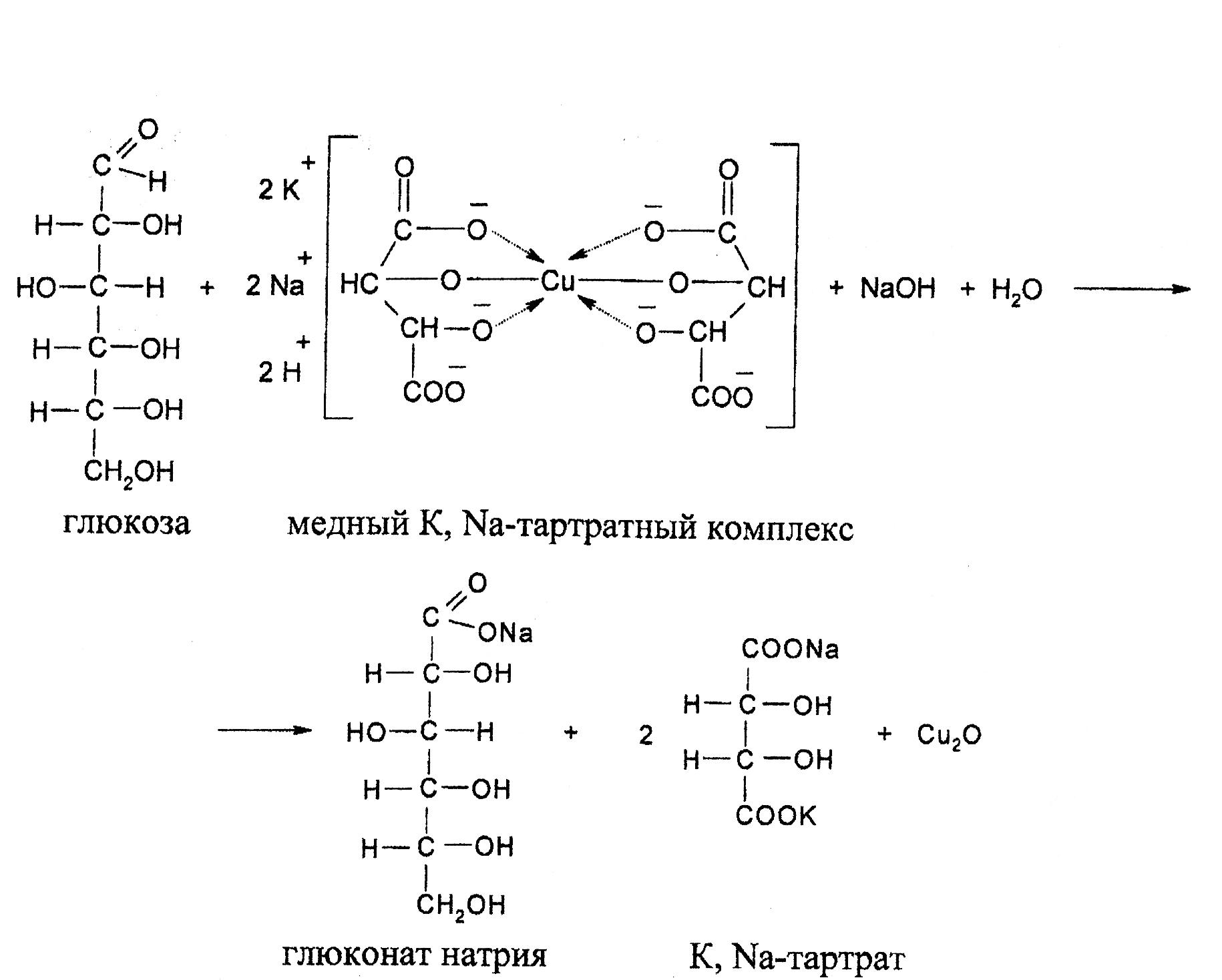
Реакция Фелинга
Реакция Фелинга является модификацией реакции Троммера, в которой вместо Cu(OH)2 применяется алкоголят меди с сегнетовой солью (K, Na-виннокислый) в щелочной среде. Химизм реакции тот же, что и в реакции Троммера. Преимуществом фелинговой жидкости является то, что медь при избытке реактива не выпадает в осадок в виде оксида меди (II). Раствор Фелинг I представляет собой приблизительно 7% водный раствор СuSO4. 5H2O. Раствор Фелинг II представляет собой раствор сегнетовой соли в едкой щелочи. При сливании растворов I и II образуется растворимая медная комплексная соль типа алкоголята меди синего цвета. Алкоголяты меди при нагревании разрушаются в присутствии моносахаридов с образованием алкоголятов сахара с последующим их разрушением. Реактивы:
Проведение опыта В пробирку наливают 1 мл раствора глюкозы и добавляют равный объем реактива Фелинга. Смесь нагревают на спиртовке до кипения. Образовавшийся красный осадок оксида меди (I) свидетельствует о положительной реакции на реактив Фелинга. Проделать реакцию Фелинга с фруктозой, сахарозой, мальтозой.
Источник