Регуляция глюконеогенеза.
Важным моментом в регуляции глюконеогенеза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда же в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидрогеназного комплекса. Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению в глюкозу.
Вторым важным моментом в регуляции глюконеогенеза является реакция, катализируемая фруктозо-1,6-бифосфатазой — ферментом, который ингибируется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т.е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ низка, в клетке наблюдается расщепление глюкозы.
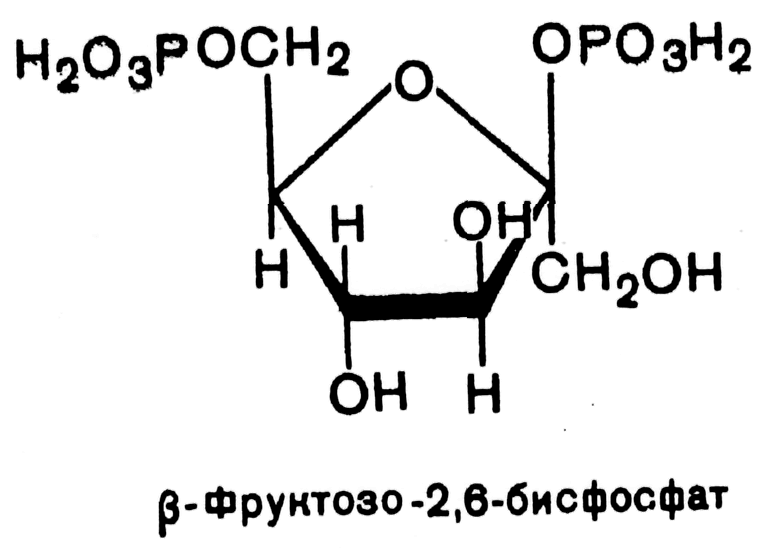
В 1980 г. группой бельгийских исследователей (Г.Херс и соавт.) в ткани печени был открыт фруктозо-2,6-бисфосфат, который является мощным регулятором активности двух вышеперечисленных ферментов:
Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бифосфатазу. Повышение в клетке уровня фруктозо-2,6-бисфосфата способствует усилению гликолиза и уменьшению скорости глюконеогенеза.
При снижении концентрации фруктозо-2,6-бисфосфата отмечается обратная картина.
Установлено, что биосинтез фруктозо-2,6-бисфосфата происходит из фруктозо-6-фосфата при участии АТФ, а распадается он на фруктозо-6-фосфат и неорганический фосфат. Биосинтез и распад фруктозо-2,6- бисфосфата катализируется одним и тем же ферментом, т.е. данный фермент бифункционален, он обладает и фосфокиназной и фосфатазной активностями:
АТФ АДФ
Фруктозо-6-фосфат фосфокиназное действие Фруктозо-2,6-бисфосфат
Показано также, что бифункциональный фермент в свою очередь регулируется путем цАМФ-зависимого фосфорилирования. Фосфорилирование приводит к увеличению фосфатазной активности и снижению фосфокиназной активности бифункционального фермента. Этот механизм объясняет быстрое действие гормонов, в частности глюкагона, на уровень фруктозо-2,6-бисфосфата в клетке.
Активность бифункционального фермента регулируется также и некоторыми метаболитами, среди которых наибольшее значение имеет глицерол-3-фосфат. Действие глицерол-3-фосфата на фермент по своей направленности аналогично эффекту, который наблюдается при его фосфорилировании с помощью цАМФ-зависимых протеинкиназ.
В настоящее время фруктозо-2,6-бисфосфат, помимо печени, обнаружен и в других органах и тканях животных, а также у растений и микроорганизмов.
Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пируваткиназа существует в двух формах: L и М. Форма L (от англ. liver — печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингибируется избытком АТФ и некоторыми аминокислотами, в частности анилином. М-форма (от англ. Muscle — мышца) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией имеет место ингибирование L-формы пируваткиназы, и как следствие этого, гликолиз замедляется и создаются условия, благоприятствующие глюконеогенезу.
Источник