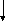Органическая химия.3828
Рис. 14. Показание шкалы для правовращающего вещества (+α): а – приближенное («грубое») измерение: α п ~ 1,5°; б – с риской лимба совпала риска нониуса 36; уточняющее измерение α у = 0,36°. Точный результат измерения: α н = α п + α у = = 1,5 + 0,36 = 1,86°; α изм. = α н = 1,86
Рис. 15. Показания шкалы для левовращающего вещества (–α): а – приближенное («грубое») измерение: α н ~ 358,5°4 б – с риской лимба совпала риска нониуса 20; уточняющее измерение α у = 0,20°. Точный результат измерения: α н = α п + α у = 358,5 + 0,20 = 358,70 ; α изм. = α н – 360 = 358,70 – 360 = –1,30
«0» нониуса показывает на шкале лимба α с точностью до 0,5° – «грубое» измерение . Для получения точного (до 0,02°) результата измерения нужно найти пару наиболее точно совпадающих делений (рисок) лимба и нониуса (две риски образуют единую линию без излома). Показание на шкале нониуса , совпадающее с риской лимба, дает деся- тые и сотые доли градуса . Полный точный результат измерения – сумма показаний лимба и нониуса (см. пояснения к рис. 14 и 15). Окончательный (истинный) результат измерения угла вращения плоскости поляризации получается с учетом поправки нуля прибора. Г. ПОРЯДОК РАБОТЫ НА ПРИБОРЕ СМ-3 1. Включение прибора Поляриметр включить в сеть переменного тока 220 В и выдержать не менее 10 мин. 2. Наполнение кюветы раствором Отвинтить колпачок кюветы, снять покровное стекло с прокладкой и убедиться, что второй (нижний) колпачок завинчен плотно. Трижды ополоснуть кювету исследуемым раствором и, держа трубку вертикально, налить раствор в кювету до появления на конце трубки выпуклого мениска жидкости. Покровным стеклом «срезать» мениск, надвигая шайбу-прокладку, надеть колпачок прорезью на шпенек кюветы и плотно завернуть накидную гайку. Оставшийся пузырек воздуха завести в расширенную зону кюветы. Покровные стекла с наружной стороны тщательно протереть мягкой салфеткой. Кювету с раствором установить в кюветное отделение поляриметра посередине и выдержать не менее 1 мин. Вращением втулки установить окуляр полей сравнения (навести «резкость» картины 4а или 4в и впоследствии при измерениях втулку окуляра не трогать). 3 . Осуществление измерения Измерение проводить в следующей последовательности. 1. Совместить на шкале нули лимба и нониуса. 2. Поворотом ручки найти положение лимба, соответствующее равной затемненности обеих половин поля зрения (рис. 13, б ). Небольшие повороты ручки лимба влево и вправо должны давать картины, соответствующие приведенным на рис. 13, а и в . Процедуру перехода от рис. 13, а и в к картине рис. 13, б нужно осуществлять, не снимая руки с ручки лимба.
3. Получить картину (рис. 13, б ) и снять замер со шкалы прибора. Сместить лимб вправо или влево и опять осуществить замер. Сделать измерения не менее трех-четырех раз и получить из этих результатов средний: 1 2 3 4 .
| ср | 4 |
Получить истинный результат с учетом поправки (α ист = α ср – П) и вычислить величину 20 100 ист , D сl где с – концентрация раствора (г/мл), l – длина кюветы с раствором [дм]. Порядок проведения лабораторной работы 1. Заранее ознакомиться с сутью метода ПМ и принципом действия поляриметра и сделать конспект теоретической части (пп. А и Б). 2. В начале практической работы: – включить в сеть (для прогрева) прибор СМ-3; – поставить в кипящую водяную баню на 1–1,5 ч конические колбы с растворами: (а) глюкоза – на эпимеризацию (~100 мл глюкозы + 2–3 капли NaOH); (б) сахароза – на гидролиз (~100 мл сахарозы + [1 мл Н 2 О + 1 мл H 2 SO 4(конц.) ]). 3. Ознакомиться с прибором СМ-3 и методикой снятия замера со шкалы прибора. 4. Для проверки положения «нуля прибора» сделать замеры α на дистиллированной воде. 5. Практические замеры α начать с равновесного (заранее приготовленного) раствора глюкозы. Потренироваться в снятии замеров α. 6. Приготовить свежий 2 %-й раствор глюкозы (навеску 4 г растворить в мерной колбе на 200 мл) и сразу замерить его угол вращения. Отметить время окончания замеров. Оставшийся раствор поставить 64
на мутаротацию. Через 30 и 60 мин стояния свежеприготовленного раствора глюкозы снова снять замеры угла вращения. 7. Замерить α исходного раствора сахарозы. 8. После 1–1,5 ч нагрева раствор эпимеризованной глюкозы охладить (под струей воды из-под крана) до 20 °С и измерить его α. Зафиксировать факт эпимеризации. 9. После 1,5–2 ч нагрева раствор гидролизованной сахарозы охладить до 20 °С и измерить α. Зафиксировать факт инверсии, оценить степень гидролиза сахарозы. 10. Результаты всех измерений α и расчетов [α] D 20 занести в соответствующие таблицы (см. ниже). Сделать выводы к каждому опыту и ко всей работе. Опыт 1. Мутаротация Мутаротация – самопроизвольное постепенное изменение оптической активности вещества после его растворения до установления постоянного угла вращения. Мутаротация характерна для моносахаридов и восстанавливающих олигосахаридов. Причиной мутаротации является превращение таутомерных форм (аномеризация) моносахарида в растворе до установления динамического равновесия между его аномерами. Таутомерное равновесие в растворах моносахаридов устанавливается через 7–10 ч после растворения. Равновесный (мутаротированный) раствор глюкозы содержит примерно 36 % α- D -глюкопиранозы и 64 % β- D -глюкопиранозы; раствор фруктозы – 40 % α- D -фруктофуранозы и 60 % β- D -фруктофу- ранозы.
| Глюкоза (2 % раствор) | α 1 | α 2 | α 3 | α 4 | α cр | [α] D 20 |
Свежеприготовленный После 30 мин стояния После 60 мин стояния Равновесный (заранее приготовленный)
| CH OH | CH 2 OH | ||||||||||||||||||||||||
| 2 | H | ||||||||||||||||||||||||
| H | O | H | O | OH | |||||||||||||||||||||
| H | H | ||||||||||||||||||||||||
| OH | H | OH | H | ||||||||||||||||||||||
| HO | OH | CH OH | HO | H | |||||||||||||||||||||
| H | OH | H | OH | ||||||||||||||||||||||
| 2 | OH | ||||||||||||||||||||||||
| -D- глюкопираноза | H | -D- глюкопираноза | |||||||||||||||||||||||
| O | |||||||||||||||||||||||||
| H | C | ||||||||||||||||||||||||
| OH | H | ||||||||||||||||||||||||
| H | |||||||||||||||||||||||||
| CH 2 OH | HO | CH 2 OH | |||||||||||||||||||||||
| H | OH | ||||||||||||||||||||||||
| H | HO | OH | |||||||||||||||||||||||
| HO | O | O | |||||||||||||||||||||||
| открытая форма | |||||||||||||||||||||||||
| глюкозы | |||||||||||||||||||||||||
| OH | H | OH | H | ||||||||||||||||||||||
| H | H | ||||||||||||||||||||||||
| OH | H | ||||||||||||||||||||||||
| H | OH | H | OH | ||||||||||||||||||||||
| -D- глюкофураноза | -D- глюкофураноза | ||||||||||||||||||||||||
Построить график [ ] 20 D = f ( ) протекания мутаротации во времени. Сделайте вывод. Опыт 2. Эпимеризация Эпимеризация – пространственная изомеризация моносахарида в растворе, идущая при нагреве под действием малой концентрации рас- твора NaOH (~0,35 %) или иона молибдата ( MoO 2 4 ), а также стерео- специфических ферментов, – «принудительный» процесс в отличие от самопроизвольной мутаротации. Эпимеры – стереоизомеры, отличающиеся положением в пространстве ОН-группы у С 2 (или кетогруппа у С 2 ). Здесь в эпимерное «семейство» входят: глюкоза, манноза и фруктоза. Процесс эпимеризации (превращения одного эпимера в другой) происходит через стадию образования ендиола:
| O | 1 | ОН | |||
| C | |||||
| * 2 | OH | ||||
| H — C | |||||
| R’ | 1 | 1 | |||
| [D-глюкоза] | HO | С H | СH 2 OH | ||
| или, или | C 2 | 2 C = O | |||
| H | 1 | O | HO | ||
| C | |||||
| 2 | R’ | R’ | |||
| * | |||||
| HO — C | H | [ендиол-1,2] | (C 3 -C 6 ) | ||
| [D-фруктоза] | |||||
| R’ | |||||
[D-манноза] После эпимеризации равновесного раствора глюкозы в смеси могут содержаться все три эпимера – глюкоза, фруктоза и манноза. Сделайте вывод.
| Глюкоза (2 % раствор) | α 1 | α 2 | α 3 | α cр | [α] D 20 |
| Равновесный (заранее | |||||
| приготовленный) | |||||
| Эпимеризованный (после | |||||
| нагревания с NaOH) |
Опыт 3. Инверсия саахарозы Инверсия – изменение не только величины, но и направления угла вращения сахарозы (+66,5°) в результате кислотного гидролиза из-за расщепления ее молекулы на глюкозу (52,3°) и фруктозу (–92,3°). Полностью гидролизованная сахароза – инвертный сахар – содержит 1:1 глюкозу и фруктозу и имеет [ ] 20 D = – 32,6° (см. пояснение к табл. 1).
Поскольку раствора H 2 SO 4 к раствору сахарозы добавлено небольшое количество (во избежание значительного отклонения от концентрации сахарозы 2 %) – гидролиз сахарозы проходит не полностью. По результатам измерений [ ] 20 D можно оценить степень гидролиза сахарозы сравнением практически полученной в опыте величины [ ] 20 D со справочной величиной [ ] 20 D для инвертного сахара (полностью гидролизованной сахарозы). Из каждой одной молекулы сахарозы получается при гидролизе одна молекула глюкозы и одна молекула фруктозы ( написать реакцию гидролиза сахарозы ). Если доля гидроли-
| зованных молекул сахарозы Y , | то [ | ] 20 D (измер.) = | (1 – | Y ) [ ] 20 D | (сах.) + | |||
| + Y [ ] 20 D (глюк.) + Y [ ] 20 D (фрукт.) = (1 – Y ) 66,5 + Y 52,3 + Y (–92,3). | ||||||||
| Откуда степень гидролиза сахарозы: | ||||||||
| 20 | 66,5 | |||||||
| D (измер.) | ||||||||
| Y | . | |||||||
| 106,8 | ||||||||
| Измерение отрицательных углов вращения гидролизованной саха- | ||||||||
| розы, см. пояснения к рис. 15. | ||||||||
| Углевод | α 1 | α 2 | α 3 | α 4 | α cр | Y | ||
| Сахароза | ||||||||
| Инвертный сахар | ||||||||
| Сделайте вывод. | ||||||||
Источник
5. Эпимеризация
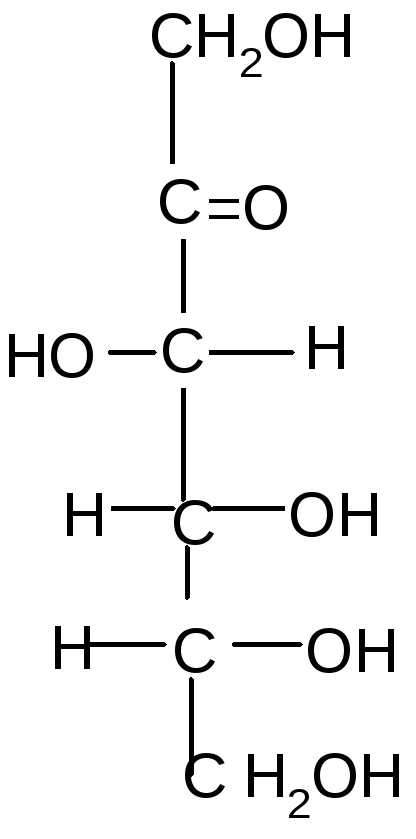
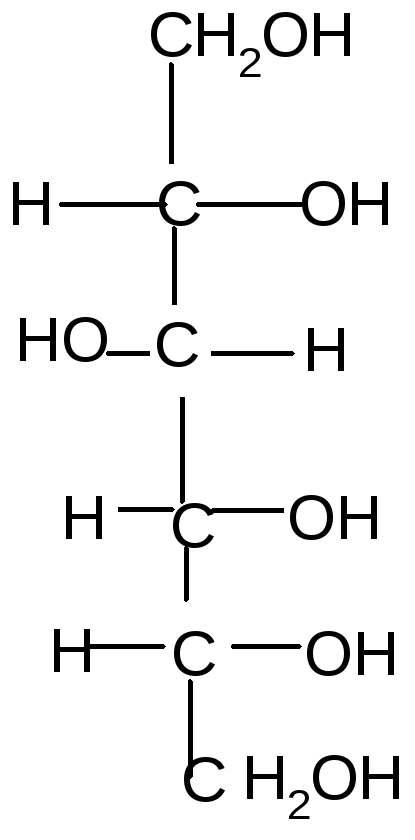
Под действием щелочей некоторые моносахариды, отличающиеся конфигурацией одного хирального центра, могут превращаться друг в друга через промежуточное образование общейендиольной формы:
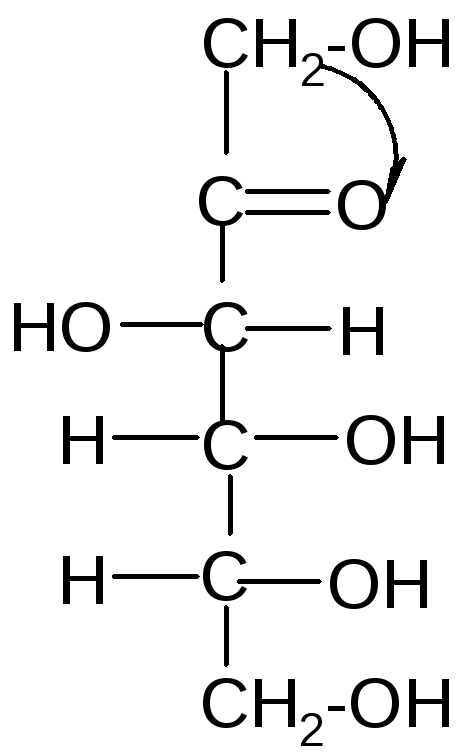
Стереоизомеры, отличающиеся конфигурацией одного хирального центра, называются эпимерами, а процесс их взаимного превращения друг в друга в щелочной среде – эпимеризацией.
6. Химические свойства моносахаридов
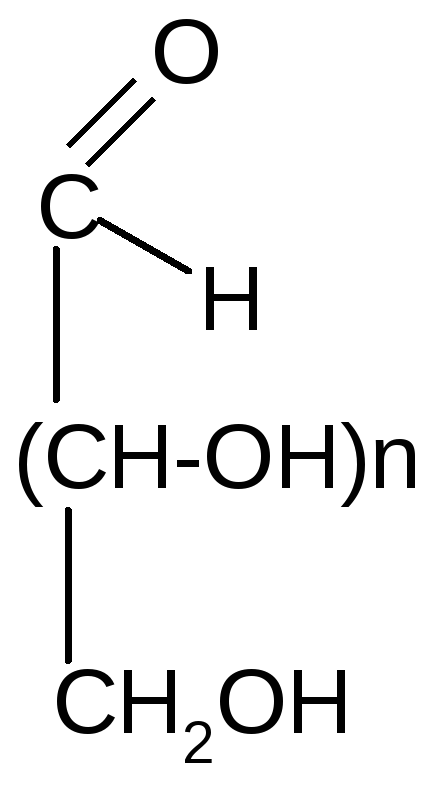
1. Окисление
а) мягкое (см. лабораторные работы) 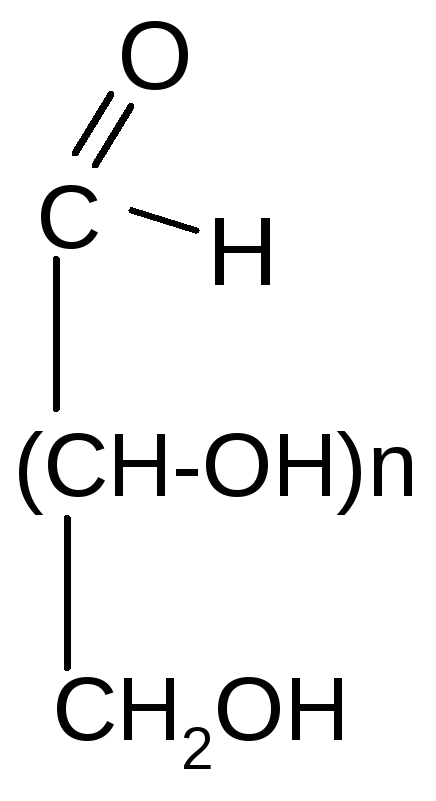
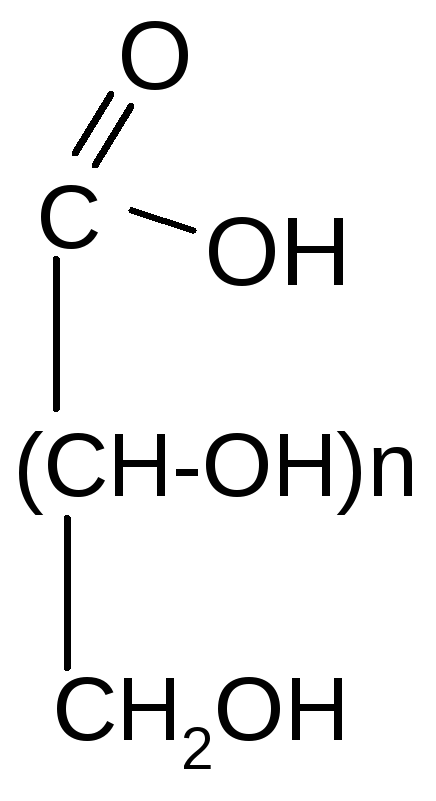

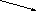

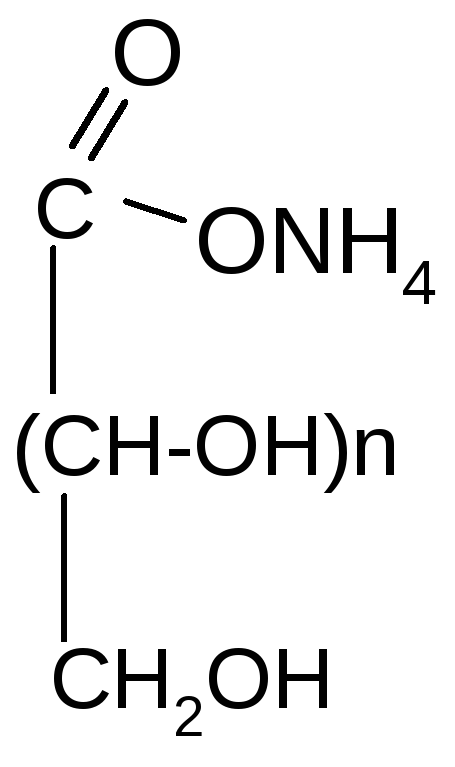


Галактаровая и др.) кислоты
в) ферментативное: 
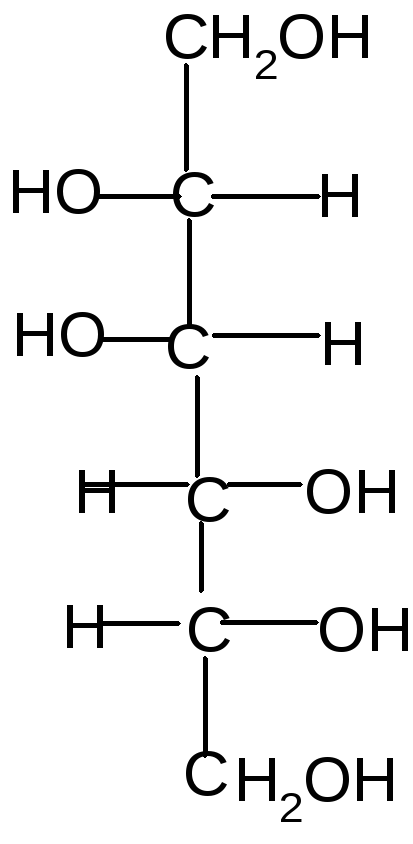


- Реакции гликозидного (полуацетального) гидроксила.


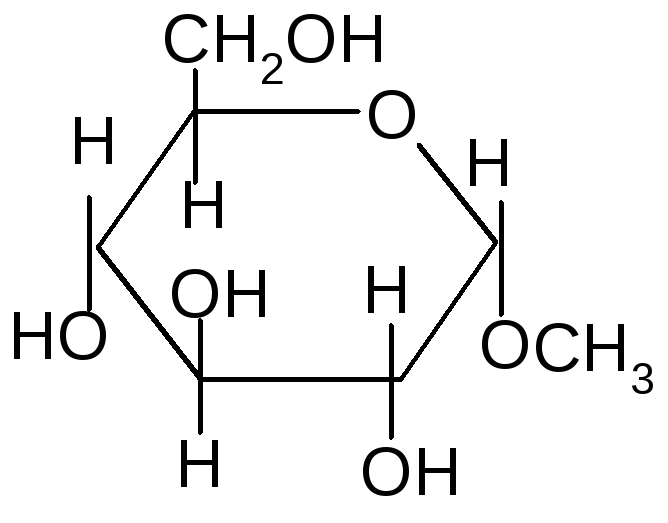



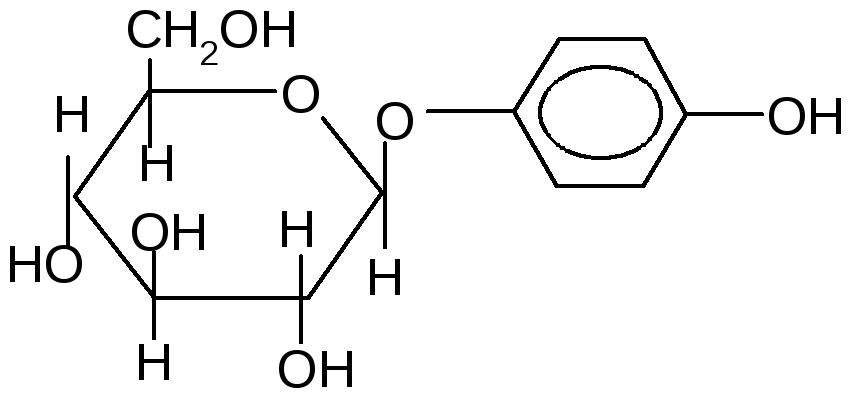
- ОбразованиеN-гликозидов.СредиN–гликозидов наиболее распространены нуклеозиды, являющиеся компонентами нуклеиновых кислот


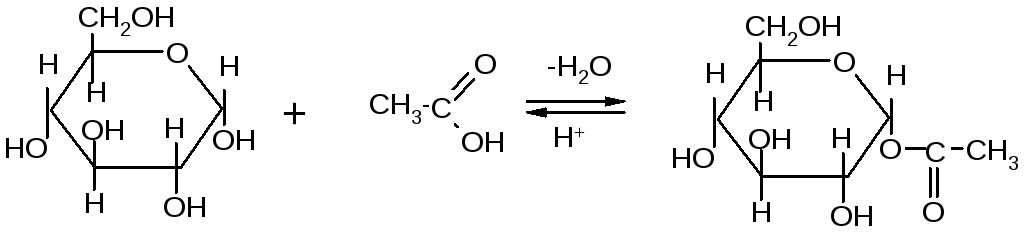
- Алкилирование.
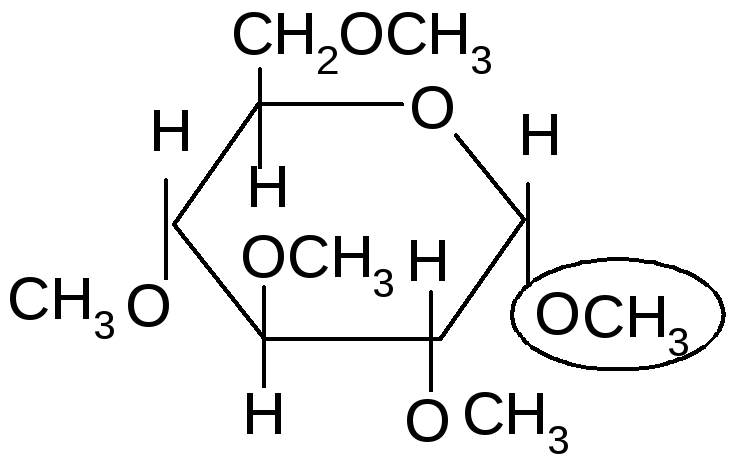
Если спирты способны алкилировать только полуацетальный или полукетальный гидроксил, то более сильные алкилирующие агенты: диметилсульфат или йодистый метил в щелочной среде алкилируют все спиртовые группы углеводов с образованием простых эфиров. 




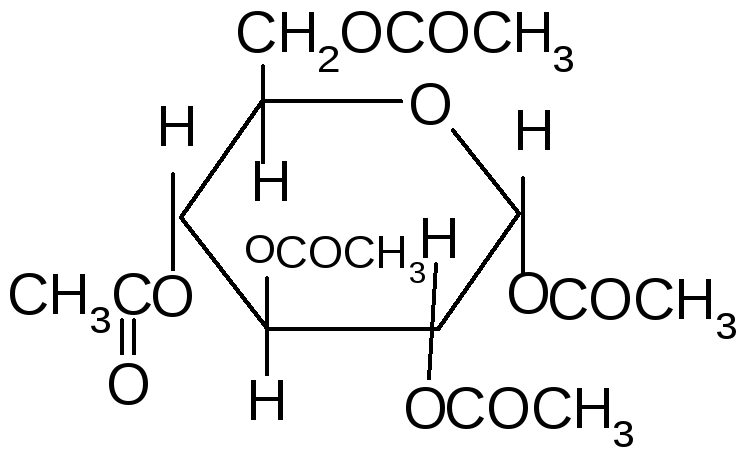
Источник